Riassunto
Vengono presentati i risultati di censimenti relativi a 22 specie di uccelli acquatici nidificanti nel 2016-2018 nella laguna aperta di Venezia, intendendo con questo termine l’intero bacino lagunare con la sola esclusione delle valli da pesca ed inclusi i litorali. Complessivamente hanno nidificato da un minimo di 8.751 coppie nel 2018 ad un massimo di 11.574 nel 2016, con una media di circa 9.900 coppie. La specie più abbondante è risultata il gabbiano reale Larus michahellis (circa il 33% del totale, in media), seguita da beccapesci Thalasseus sandvicensis (17%) e pettegola Tringa totanus (12%); la diversità del popolamento (H’) è risultata compresa tra 1,9 e 2,10. La laguna aperta di Venezia si conferma area di grande importanza per la nidificazione degli uccelli acquatici, con dieci specie presenti con popolazioni riproduttive superiori al 10% del totale recentemente stimato per l’Italia. Ogni anno mediamente il 54% delle coppie ha nidificato su siti di origine artificiale (barene artificiali e casse di colmata), il 36% su barene naturali, il 7% su isole abbandonate; trascurabile (<3%) la nidificazione in altri siti. Nel medio periodo (2013-2018) si osservano andamenti, analizzati con il software TRIM, positivi e statisticamente significativi per quattro specie (volpoca Tadorna tadorna, marangone minore Microcarbo pygmaeus, cormorano Phalacrocorax carbo, beccaccia di mare Haematopus ostralegus), mentre la pettegola risulta stabile. Per le rimanenti 17 specie non si osservano variazioni significative, causa l’elevata variazione interannuale. Ai fini della conservazione delle importanti popolazioni nidificanti nella laguna aperta sono auspicabili interventi di gestione naturalistica dei siti artificiali e di conservazione attiva di quelli naturali.
Abstract
Waterbirds breeding in the lagoon of Venice (NE Italy): estimates for the years 2016-2018 and mean-term trends.
The results of censuses of 22 species of waterbirds nesting in 2016-2018 in the lagoon of Venice, fish farms not included, are presented. Altogether there was a minimum of 8,751 pairs in 2018 and a maximum of 11,574 pairs in 2016, with an average of about 9,900 pairs. The most abundant species was the Yellow-legged Gull Larus michahellis (about 33% of the total, on average), followed by the Sandwich Tern Thalasseus sandvicensis (17%), the Common Redshank Tringa totanus (12%); population diversity (H’) ranged between 1.9 and 2.10. The lagoon of Venice remains an area of great importance for the breeding waterbirds, with ten species occurring with figures exceeding 10% of the Italian population. Every year on average 54% of pairs nested on artificial sites, such as dredge intertidal islands (about 130 sites, with an overall extension of 1,300 ha) and three large artificial islands; 36% of pairs nested on saltmarshes; 7% on small, uninhabited islands; 3% on the littoral strip and small artificial structures (concrete platforms, wooden poles, etc.). In the medium period (2013-2018) the trends, analysed with the software TRIM, were positive and statistically significant for four species (Shelduck Tadorna tadorna, Pygmy Cormorant Microcarbo pygmaeus, Great Cormorant Phalacrocorax carbo, Eurasian Oystercatcher Haematopus ostralegus), while the Common Redshank was stable. No significant changes were observed for the remaining 17 species, likely due to the high interannual variation. For the conservation of the important nesting populations, active management of the artificial sites and conservation of the natural ones are suggested.
Premessa
Monitoraggi di medio e lungo periodo degli uccelli acquatici nidificanti sono regolarmente effettuati in numerose zone umide, per la riconosciuta importanza di queste specie nel fornire informazioni, non sempre semplici da interpretare o univoche, sullo stato di salute dell’ecosistema (Stolen et al., 2004; Amat e Green, 2010; Ogden et al., 2014). Dimensioni delle popolazioni, successo riproduttivo, utilizzo degli habitat trofici e di nidificazione, presenza di inquinanti xenobiotici nei tessuti, sono i parametri che più spesso vengono studiati (Schreiber e Burger, 2002; Kushlan e Hafner, 2010; Kalisińska, 2019). Trattandosi in molti casi di specie incluse nella Direttiva 147/09/CE Uccelli, per i Paesi europei il loro monitoraggio rientra inoltre nelle misure obbligatorie, al fine di aggiornare le conoscenze sul loro stato di conservazione.
Nel Mediterraneo pochi studi sono stati condotti per lunghe serie temporali; Redolfi De Zan et al. (2011) riportano un elenco di quelli svolti in Italia. Nella laguna di Venezia, con esclusione delle valli da pesca, censimenti annuali di alcune specie di Laro-limicoli sono iniziati nel 1989 (Scarton e Valle, 2015), e proseguiti senza soluzione di continuità fino ad oggi, configurandosi come uno dei più lunghi monitoraggi ancora in atto nel nostro Paese.
Tuttavia le prime valutazioni su dimensioni e andamenti di un insieme molto più numeroso, oltre venti specie di uccelli acquatici, sono state effettuate solo a partire dal 2013 (Scarton e Valle, 2017). Le specie appartengono a gruppi ecologico-funzionali distinti (ittiofagi obbligati; consumatori di piccoli Invertebrati; filtratori, ecc.), utilizzano per nidificare ambienti diversi (isolotti con bassa vegetazione alofila; canneti; piccole formazioni arboree e arbustive), si caratterizzano per livelli differenti di tolleranza al disturbo antropico, sono presenti in laguna di Venezia con fenologia diversa (specie stanziali o estive). L’andamento temporale di questo insieme di specie di uccelli acquatici può fornire un’informazione integrata sullo stato dell’intero ecosistema lagunare, non limitata quindi a singoli comparti ambientali. In questa nota si presentano dati per il 2016-2018 e si analizzano, utilizzando informazioni già pubblicate da Scarton e Valle (2017), i trend osservati in un periodo più esteso, vale a dire il 2013-2018.
Area di indagine
L’area di indagine è costituita dall’intero settore lagunare sottoposto all’escursione di marea, per una superficie complessiva di circa 45.000 ettari, e dai litorali compresi tra la foce del Sile a Nord e quella del Brenta a sud. Sono escluse dall’area di studio tutte le valli da pesca arginate, circa 10.000 ettari, mentre viene incluso un isolotto posto alla confluenza tra Brenta e Bacchiglione, ubicato a circa 100 metri dal margine lagunare e tradizionale sito di nidificazione di uccelli coloniali.
Materiali e metodi
Per 22 specie di uccelli acquatici nidificanti appartenenti a sette famiglie è stato possibile raccogliere adeguati dati di campo o elaborare stime che si ritiene siano sufficientemente realistiche. In ciascuno dei tre anni di indagine, tra la fine di aprile e i primi di agosto sono state effettuate 40-50 uscite in campo, con imbarcazioni a ridotto pescaggio in laguna aperta, o a piedi lungo i litorali e nelle casse di colmata A, B e D/E. Un volo aereo a bassa quota è stato eseguito sull’intera laguna nel mese di giugno di ogni anno, a integrazione dei dati acquisiti sul terreno; a partire dal 2017 è stato impiegato sistematicamente anche un drone (Valle e Scarton, 2018). Le uscite si sono sempre svolte tra le ore 7 e le 17, in assenza di alte maree sostenute e con condizioni meteorologiche favorevoli.
I siti di possibile nidificazione sono stati raggruppati in sei tipologie e censiti secondo modalità diverse, così riassumibili:
- piccole isole. Si tratta di numerose isole di modesta estensione, di solito inferiori a 10 ha, quasi sempre non abitate e ricoperte in gran parte da vegetazione arborea ed arbustiva. In questa categoria è stata inserita anche l’isola artificiale delle Tresse, di superfice maggiore e pressoché priva di vegetazione arborea; per questo sito i dati degli Autori sono stati integrati per il solo fratino e per l’anno 2016 con quelli presentati da Borgo et al. (2018). Le piccole isole sono state visitate almeno due volte nel corso di ciascuna stagione riproduttiva. Per l’intrinseca difficoltà di censire alcune specie che vi si riproducono, le stime elaborate per questi siti sono probabilmente inferiori alla situazione effettiva. I dati delle garzaie presenti nel 2017 sono largamente coincidenti con quelli riportati in Scarton et al. (2019);
- barene naturali. Isolotti intertidali ricoperti da vegetazione alofila, hanno un’estensione complessiva di circa 3.600 ettari. Le barene che ospitavano colonie di Caradriformi sono state visitate almeno tre volte nell’ambito di ciascuna stagione riproduttiva e il numero di coppie stimato è stato posto pari a quello dei nidi attivi; per i dettagli metodologici si veda Scarton e Valle (2015). In alcuni ampi settori lagunari sono stati effettuati censimenti mirati di pettegola Tringa totanus. Per tutte le specie i dati di campo sono stati integrati laddove necessario con stime personali per le aree poco o non coperte;
- barene artificiali. Isolotti intertidali artificiali, realizzati tramite sedimenti provenienti dal dragaggio di canali lagunari (Scarton et al., 2013b); nel 2018 erano circa 130, per un’estensione di poco più di 1.300 ha. Sono stati visitati almeno due volte nel periodo compreso tra aprile e i primi di agosto, con censimento completo delle coppie nidificanti (probabili e certe) presenti;
- casse di colmata A, B e D/E. Si tratta di tre vaste isole artificiali, estese nel complesso per circa 1.200 ettari, realizzate alla fine degli anni Sessanta del secolo scorso. Le due più grandi (B e D/E) sono quasi del tutto prive di qualsiasi infrastruttura, mentre nella terza è presente da circa dieci anni un impianto di fitodepurazione esteso per quasi 100 ettari (Scarton et al., 2017). Tranne la cassa di colmata A, visitata una sola volta ogni anno, le altre due sono state perlustrate in diverse occasioni, anche con l’utilizzo di un drone;
- altri siti artificiali. Si tratta di un eterogeneo complesso di piccoli manufatti presenti nella laguna aperta, come ruderi di casoni abbandonati, piattaforme di mareografi, briccole, ecc. I siti utilizzati da coppie sono stati visitati due volte nel corso di ogni stagione riproduttiva;
- litorali sabbiosi. Con uno sviluppo lineare di circa 40 km, gli habitat potenzialmente idonei alla nidificazione delle specie qui considerate hanno un’ampiezza esigua, spesso inferiore a 100 m. In questa categoria è stato incluso anche lo scanno del Bacàn, interno alla laguna. I dati relativi alle poche specie che si riproducono nei litorali provengono sia da osservazioni personali che da altre fonti quali relazioni tecniche relative a monitoraggi faunistici (Ministero delle Infrastrutture e dei Trasporti – Provveditorato Interregionale alle OO.PP. del Veneto-Trentino Alto Adige-Friuli Venezia Giulia e CORILA, 2017-2019) e pubblicazioni scientifiche (Baldin et al., 2019; Mitri et al., 2019).
I metodi di indagine sono stati diversi a seconda delle specie considerate: 1) per volpoca e limicoli si sono stimate le coppie nidificanti sulla base degli individui allarmanti e/o del ritrovamento di nidi con uova e/o pulcini (Gagliardi e Tosi, 2012): il totale riportato si riferisce sempre alle coppie probabili + quelle certe; 2) per falacrocoracidi e ardeidi si sono stimati i nidi presenti in base agli adulti che li occupavano, in una fase precoce della nidificazione (Scarton et al.,2013a); successive visite alle garzaie sono state utilizzate per una valutazione circa le specie non insediatesi in precedenza; 3) per i laridi si sono sempre conteggiati i nidi apparentemente occupati (Scarton et al., 2018). Per comodità di lettura e di elaborazione dei risultati si presenta sempre un solo valore di coppie nidificanti, il minimo stimato, per ciascuna specie. La diversità dei popolamenti annuali è stata calcolata mediante l’indice di Shannon (Magurran, 2004); per l’effettuazione di questa e di altre analisi statistiche si è utilizzato il software PAST (Hammer et al., 2001).
Per la valutazione dei trend delle specie presenti ogni anno tra il 2013 ed il 2018 è stato utilizzato il software TRIM (Trends and Indices for Monitoring data – versione 3.53: Pannekoeke Van Strien, 2005). Il software classifica i trend in sei possibili categorie, in base alla presenza, o meno, di variazioni annue statisticamente significative e superiori al 5%. Oltre a quattro categorie con variazioni significative in incremento o decremento, vi sono anche le categorie “stabile” (nessun significativo aumento o diminuzione e variazione <5% annuo) e “incerto” (nessun significativo aumento o diminuzione, ampi intervalli di confidenza). In base a quanto suggerito da Vořišeket al. (2008), è stata scelta l’opzione Time Effects Model; per i dettagli si rimanda a GPSO(2017). Infine, per la nomenclatura scientifica e l’ordinamento sistematico si è fatto riferimento alla recente lista CISO-COI 2019 degli uccelli italiani (Baccetti et al., 2019).
Risultati
La Tab. 1 riporta i risultati per il triennio considerato. Complessivamente si stima abbiano mediamente nidificato circa 9.900 coppie delle 22 specie considerate, con minimo di 8.751 nel 2018 ed un massimo di 11.574 nel 2016. La forte variazione si deve quasi esclusivamente al gabbiano corallino Larus melanocephalus, di cui circa 2.500 coppie hanno nidificato nel solo 2016; escludendo questo valore, i totali per ciascuno dei tre anni risultano allineati attorno alle 9.200 coppie nidificanti.
Considerando la media triennale (Tab. 1), la numerosa popolazione di uccelli acquatici nidificanti nella laguna aperta appare dominata dal gabbiano reale Larus michahellis (circa un terzo del totale), seguita da beccapesci Thalasseus sandvicensis (16%) e pettegola (12%). Otto specie presentano valori compresi tra 1% e 10%, mentre le rimanenti 11 costituiscono ciascuna meno dell’1% del totale. L’indice di diversità di Shannon diminuisce nel triennio, ma in modo molto contenuto (da 2,10 a 1,9) mentre, all’opposto, aumenta di poco la dominanza (da 0,16 a 0,22).
Un’analisi condotta per gruppi sistematici indica quanto segue:
- la volpoca Tadorna tadorna evidenzia un discreto incremento nel triennio. Oltre alle coppie nidificanti, sono regolarmente presenti alcune centinaia di individui non riproduttori;
- gli ardeidi diminuiscono (-40% tra 2016 e 2018), a causa soprattutto del calo della garzetta Egretta garzetta;
- notevole invece l’incremento nel triennio sia di cormorano Phalacrocorax carbo (+125%) che di marangone minore Microcarbo pygmaeus (+40%);
- in modesto calo i limicoli (Recurvirostridae, Charadriidae e Scolopacidae), che passano complessivamente da 2104 a 1867 coppie (-11%). Con eccezione della beccaccia di mare Haematopus ostralegus, la cui popolazione continua ad aumentare, appaiono in diminuzione tutte le altre specie. Tra queste ultime, il calo percentuale maggiore (-40%) è dovuto al fratino Charadrius alexandrinus, che si assesta a meno di 69 coppie;
- per i larini il calo è evidente, ma dovuto in gran parte al già citato episodio massivo di nidificazione nel solo 2016 del gabbiano corallino. Il gabbiano comune Chroicocephalus ridibundus è anch’esso in calo, mentre per il gabbiano reale si evidenzia un aumento;
- in diminuzione gli sternini, con andamenti però diversi per le varie specie: forte diminuzione per il fraticello Sternula albifrons, modesta diminuzione per il beccapesci e incremento per la sterna comune Sterna hirundo.
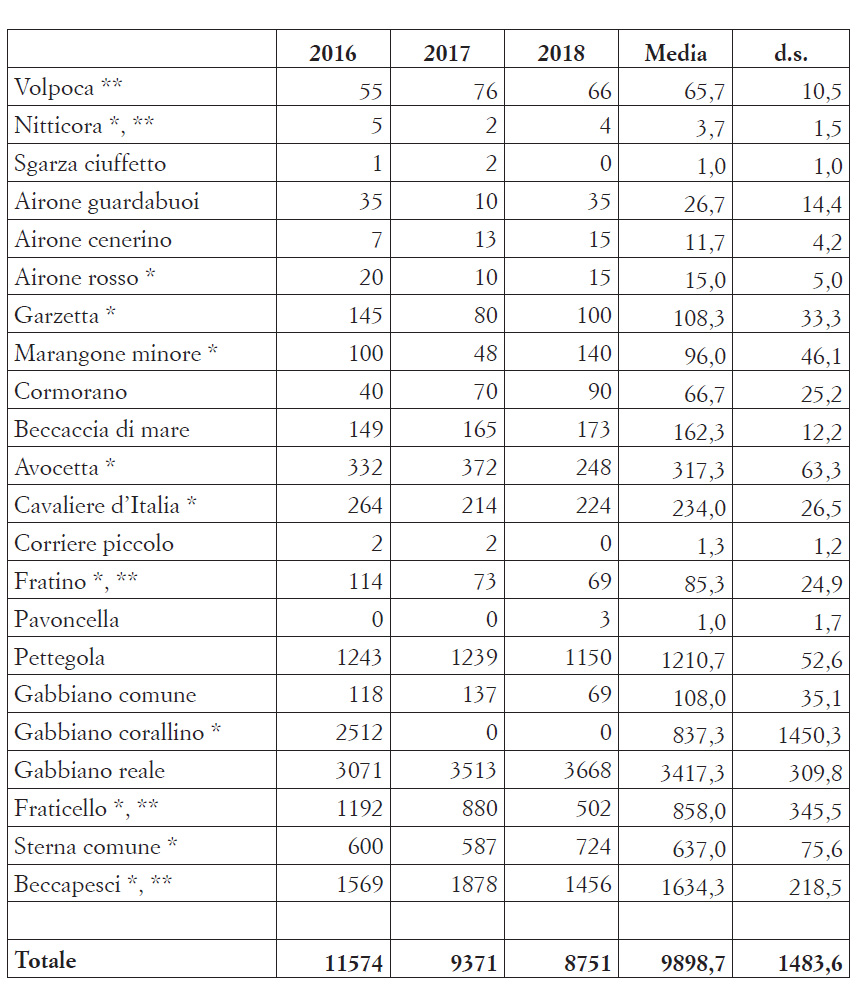
Considerando la tipologia dei siti di nidificazione, la ripartizione percentuale nel triennio è riportata in Fig. 1. Oltre il 50% delle coppie ha nidificato nelle barene artificiali: in questi siti, le specie più abbondanti sono risultate gabbiano reale, fraticello e sterna comune. Il 36% delle coppie era invece insediato su barene naturali, e tra di esse le più numerose risultavano beccapesci, pettegola e gabbiano corallino. Le piccole isole ospitavano circa il 7% della popolazione, con dominanza di gabbiano reale, garzetta e marangone minore. Valori inferiori al 3% del totale sono infine relativi alle rimanenti tre tipologie. Esempi di utilizzo di varie tipologie di siti di nidificazione sono raffigurati nelle Figg. 2-5.
Grafico

Discussione e conclusioni
Anche nel triennio 2016-2018 la laguna aperta di Venezia conferma l’importanza già verificata in anni precedenti per la nidificazione di numerose specie di uccelli acquatici, molte delle quali di interesse comunitario e/o aventi distribuzione ristretta a livello nazionale
Le specie utilizzano per la nidificazione numerose tipologie di siti; come nel recente passato (Scarton e Valle, 2017) quelli più rilevanti sono risultati sia di origine prettamente artificiale (le cosiddette barene artificiali) che altri di formazione naturale (le barene naturali). Questi due ambienti sono utilizzati soprattutto da gabbiani e sterne, in misura minore da alcuni limicoli. Gli ardeidi e i due falacrocoracidi si insediano invece sulle piccole isole e, in misura minore, nelle casse di colmata. Molto modesta l’importanza dei litorali, nei quali solo poche specie trovano habitat idonei alla nidificazione.



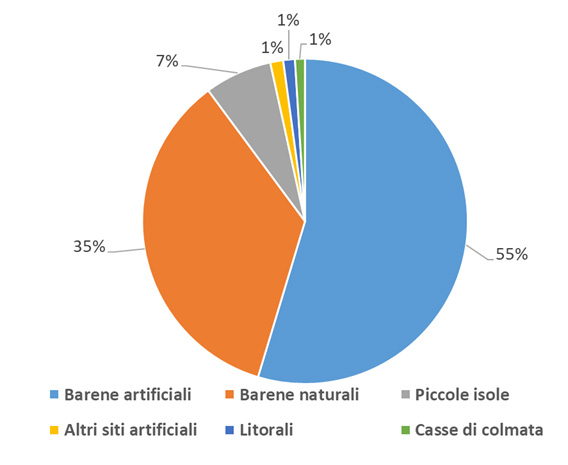
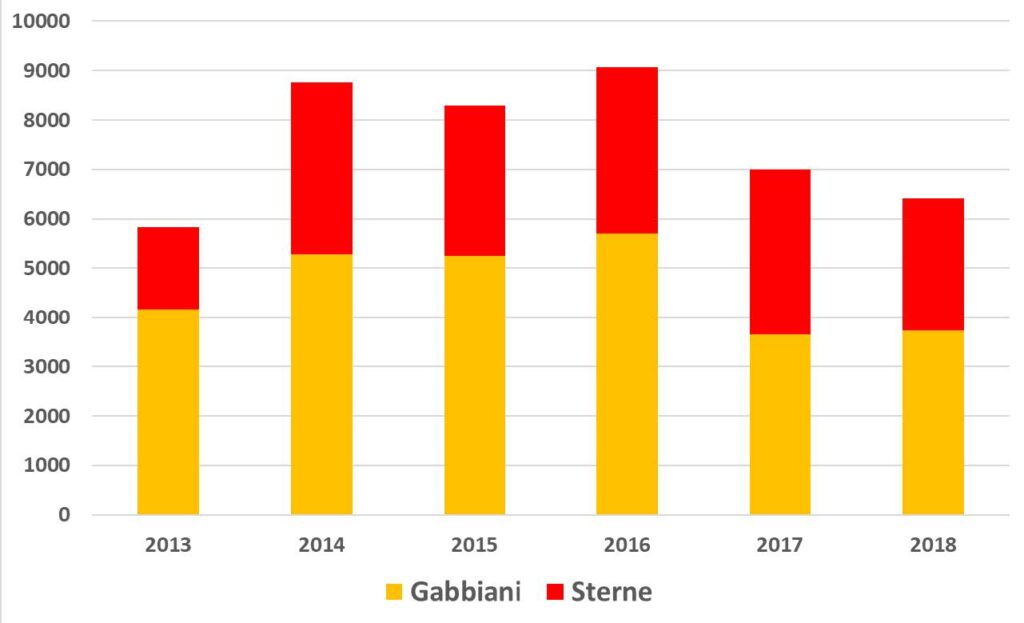
L’andamento delle specie esaminate può essere meglio descritto considerando un intervallo temporale maggiore del triennio, utilizzando quindi anche i risultati da noi presentati relativi ai censimenti degli anni 2013-2015, del tutto comparabili per metodi e area di indagine. In tal modo si riducono gli effetti sulla valutazione complessiva dovuti alle forti variazioni interannuali, che sono tipiche di molte popolazioni di uccelli acquatici nidificanti (Schreiber e Burger, 2002). La Fig. 6 riporta i valori relativi agli anni 2013-2018 per alcuni gruppi sistematici; si può osservare come la popolazione nidificante nel complesso oscilli tra 8.000 e 11.000 coppie, con una media di circa 10.000. La causa principale delle variazioni interannuali nell’intera laguna aperta è imputabile soprattutto a beccapesci e fraticello, che possono raddoppiare o dimezzare la propria popolazione da un anno all’altro. Per queste due specie, note per la loro forte coesione di gruppo (“group adherence”: McNicholl, 1975), è molto probabile che i consistenti gruppi di adulti che si spostano per nidificare nell’intero nord Adriatico, se non in buona parte del Mediterraneo, si insedino in laguna di Venezia solo in particolari annate, a seconda della disponibilità alimentare e delle condizioni meteorologiche nelle prime fasi della stagione riproduttiva. Tra i gabbiani, la specie con la maggior fluttuazione è stata il gabbiano corallino; nel 2017-2018, e anche in seguito fino al 2020 come da nostre osservazioni inedite, la specie ha abbandonato la laguna aperta, per nidificare invece con regolarità in alcune valli da pesca della laguna nord. Anche le rimanenti specie possono evidenziare evidenti variazioni, ma data la minor consistenza delle popolazioni gli effetti sui totali annuali sono del tutto trascurabili.
La Tab. 2 riporta medie e andamenti di ciascuna specie nel 2013-2018; i trend risultano statisticamente positivi per quattro specie, mentre risulta stabile la pettegola. I due falacrocoracidi si sono insediati da pochi anni nella laguna aperta, ed il loro aumento si inserisce in una dinamica espansiva osservata in tutto il Triveneto (Scarton et al., 2019); la presenza di numerose isole non ancora occupate e potenzialmente idonee lascia supporre che vi siano le condizioni per un ulteriore incremento di queste due specie. In aumento anche la beccaccia di mare, che nidifica in laguna di Venezia dal 1996, con una popolazione che da molto tempo è la più numerosa in Italia. Questa specie solo da pochi anni ha iniziato a nidificare in laguna di Venezia anche su manufatti, con i nidi che vengono posti ad alcuni metri sul livello dell’acqua, ad esempio sulla sommità di briccole ammalorate o di piattaforme di stazioni mareografiche. Se ciò rientri nel più generale utilizzo di strutture artificiali ben noto per questa specie all’estero (Reynoldset al., 2019), o se costituisca invece una recente risposta adattativa alla sempre più frequente sommersione dei siti abituali (barene artificiali) non è al momento chiaro. Le maree molto sostenute stanno diventando sempre più comuni anche nei mesi di maggio-giugno, con esiti disastrosi per le covate di diverse specie che utilizzano le barene naturali; probabilmente meno gravi le conseguenze per le nidificazioni che avvengono su barene artificiali, data la maggior altimetria di quest’ultime.
La pettegola, che nidifica prevalentemente su barene naturali e risulta stabile nel 2013-2018, è però notevolmente diminuita rispetto a quanto da noi stimato nel 2001-2006 (circa 1600 coppie: Scarton et al., 2009), riteniamo per gli effetti delle mutate condizioni meteo-marine. Per questa specie, che può essere ritenuta un ottimo indicatore dello stato di conservazione delle barene naturali, è sempre più necessario attuare un nuovo censimento sistematico che interessi non solo tutte i tradizionali ambienti di nidificazione ma anche gli habitat alofili delle casse di colmata e di alcune isole di maggiori dimensioni (ad es. Sant’Erasmo, Le Vignole, ecc.) in cui potrebbero essersi spostati gruppi di riproduttori. Recenti esperienze hanno dimostrato che con l’utilizzo di un drone si riducono drasticamente i tempi di indagine in campo per questa specie, notoriamente difficile da censire (Valle e Scarton, 2020).
La diminuzione del gabbiano reale osservata nel 2013-2018 si deve in gran parte al totale abbandono delle casse di colmata B e D/E, osservato a partire dal 2016 e che non ha chiare motivazioni; almeno in parte potrebbe essere dovuto al sovrasviluppo di Baccharis halimifolia, composita esotica ed invasiva che sta da alcuni anni colonizzando ampie estensioni di habitat alofili o mesofili delle due casse di colmata (oss. pers.), dove si insediavano le colonie di gabbiano reale. Le coppie un tempo lì nidificanti si sono probabilmente spostate in parte nelle barene artificiali e in parte nell’isola delle Tresse e nell’Oasi di Ca’ Roman; in quest’ultimo sito la loro presenza sta danneggiando, sia direttamente che indirettamente, gli habitat dunali e retrodunali di particolare pregio (oss. pers).
Per le specie considerate in questa nota, i valori medi delle popolazioni nidificanti nel 2013-2018 possono essere confrontati con gli analoghi stimati per l’Italia nel recente Rapporto sullo stato di attuazione della Direttiva Uccelli (ETCBD, 2020), con la significativa eccezione del beccapesci; per questa specie il valore riportato nel Rapporto è inutilizzabile, essendo inferiore alla sola popolazione lagunare nota per l’ultimo decennio. Nel complesso, dal confronto si evince come per 10 specie le popolazioni della laguna aperta costituiscano almeno il 10% del totale nazionale (Tab. 2).
In conclusione, i valori medi per il 2013-2018 riportati nella Tab. 2 possono essere considerati come quelli tipici per la laguna aperta, ed essere utilizzati come valori di riferimento per successivi censimenti o monitoraggi. Utilizzando opportune soglie, ad esempio decrementi superiori al 20% della media 2013- 2018, si potranno valutare i nuovi dati di popolazione e quindi effettuare, se necessario, mirati interventi gestionali, volti a conservare gli habitat naturali di nidificazione o a massimizzare il valore di quelli di origine artificiale.
Ringraziamenti
Parte dei dati è stata acquisita durante indagini eseguite nel 2016-2017 per conto del CORILA – Consorzio per il coordinamento delle ricerche inerenti al sistema lagunare di Venezia (“Studio B.6.72-B12 e B.13. Attività di rilevamento per il monitoraggio degli effetti prodotti dalla costruzione delle opere mobili alle bocche di porto”), e nel 2018 (Studio B.6.72- B.13) per conto del Consorzio Venezia Nuova. Si ringraziano il Ministero delle Infrastrutture e dei Trasporti – Provveditorato Interregionale alle OO.PP. del Veneto-Trentino Alto Adige-Friuli Venezia Giulia, tramite il suo Concessionario Venezia Nuova, ed il CORILA per aver concesso l’utilizzo dei dati; la dott.ssa C. Cerasuolo (CVN) e la dott.ssa C. Dabalà (CORILA) hanno agevolato le procedure autorizzative. Gli altri dati provengono da ricerche autofinanziate dagli Autori. Si ringraziano infine E. Checchin, M. Consentino e O. Trebbi per l’aiuto prestato in campo e la collaborazione.
Bibliografia
Amat J. A., Green A. J. (2010) – Waterbirds as bioindicators of environmental conditions. Pp. 45–52 in Hurford C., Schneider M., Cowx I., eds. Conservation monitoring in freshwater habitats. Dordrecht, The Netherlands: Springer.
Baccetti N., Fracasso G., Commissione Ornitologica Italiana (2019) – La nuova Lista CISO-COI degli uccelli italiani 2019. Internet: https://www.ciso-coi.it/coi/ checklist-ciso-coi-degli-uccelli-italiani/.
Baldin M., Perlasca P., Sartori A., Favaro M. (2019) – Il fratino, Charadrius alexandrinus Linnaeus,1758, nella spiaggia del biotopo “Dune degli Alberoni”, Lido di Venezia (Charadriiformes, Charadriidae). Bollettino del Museo di Storia Naturale di Venezia, 69: 91-100.
Borgo A., Carrer S., Regazzi A. (2018) – Primi dati sulla biologia riproduttiva del fratino Charadrius alexandrinus Linnaeus, 1758 nidificante in strutture morfologiche artificiali della Laguna di Venezia. Bollettino del Museo di Storia Naturale di Venezia, 69: 77-89.
European Topic Centre on Biological Diversity (2020) – Italy. Reporting under Article 12 of the Birds Directive (period 2013-2018). Annex B. Bird species’ status and trends report format. Internet: http://cdr.eionet.europa.eu
Gagliardi A., Tosi G. (a cura di) (2012) – Monitoraggio di Uccelli e Mammiferi in Lombardia. Tecniche e metodi di rilevamento. Regione Lombardia, Università degli Studi dell’Insubria, Istituto Oikos.
Gruppo Piemontese Studi Ornitologici (a cura di Della Toffola M. et al.), 2017 – Trent’anni di censimenti invernali degli uccelli acquatici in Piemonte e Valle d’Aosta (1979-2008). Tichodroma, 3. 263 pp.
Hammer Ø., Harper D.A.T., Ryan P.D. (2001) – PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica 4(1): 9pp. Internet: http://folk.uio.no/ohammer/past.
Kalisińska E. (2019) – Endothermic animals as biomonitors of terrestrial environments. In Kalisińska E. (ed.). Mammals and Birds as Bioindicators of Trace Element Contaminations in Terrestrial Environments. Springer, Cham: 21-53.
Kushlan J.A., Hafner, H. (eds.) (2000) – Heron Conservation. Academic Press, London. Pagg. 480.
Magurran A. (2004) – Measuring biological diversity. Blackwell Publishing, Malden. Pagg. 215.
McNicholl M.K. (1975) – Larid site tenacity and group adherence in relation to habitat. Auk, 92: 98–104.
Mitri M.G., Borgo A., Antinori F., Castelli S., Scarpa M., Bonotto L., Cesarotto C. (2019) – Allarmante situazione del fratino, Charadrius alexandrinus, sul litorale veneziano: l’emblematico caso dell’area di San Nicolò nel SIC/ZPS “Lido di Venezia: biotopi litoranei”. In: Bonato L., Spada A., Cassol M. (a cura di), Atti 8° Convegno Faunisti Veneti. Boll. Mus. St. Nat. Venezia, suppl. al vol. 69: 148-154.
Ogden J.C., Baldwin J.D., BassO.L., Browder J.A., CookM.I., FrederickP.C., Frezza P.E., Galvez R.A., Hodgson A.B., Meyer K.D., Oberhofer L.D., Paul A.F., Fletcher P.J., DavisS.M., Lorenz J.J. (2014) – Waterbirds as indicators of ecosystem health in the coastal marine habitats of Southern Florida: 1. Selection and justification for a suite of indicator species. Ecol. Indic., 44: 148-163.
PannekoekJ., van Strien A.J. (2005) – TRIM 3 Manual Trends and Indices for Monitoring Data. Research paper no. 0102. CBS Voorburg. The Netherlands Statistics, Netherlands.
Peronace V., Cecere J., Gustin M., Rondinini C. (2012) – Lista Rossa 2011 degli Uccelli Nidificanti in Italia. Avocetta, 36: 11-58.
Ministero delle Infrastrutture e dei Trasporti – Provveditorato Interregionale alle OO.PP. del Veneto-Trentino Alto Adige-Friuli Venezia Giulia tramite il suo Concessionario Venezia Nuova e CORILA, 2017-2019. Studio B.6.72 B/12 e B.13. Attività di rilevamento per il monitoraggio degli effetti prodotti dalla costruzione delle opere alle bocche lagunari. Avifauna. I Rapporto di valutazione. Internet: www.monitoraggio.corila.it.
Redolfi De Zan L., Battisti C., Carpaneto G. M. (2011) – Inter-Annual and Intra-Seasonal Patterns of Abundance in a Set of Common Waterbirds: a Long Term Study in a Mediterranean Wetland. Vie Et Milieu-Life and Environment, 61(2): 101–106.
ReynoldsJ S., Ibáñez-Álamo J.D., Sumasgutner P., MaiwaringM. (2019) – Urbanisation and nest building in birds: a review of threats and opportunities. J. Ornithol., 160: 841-860.
Scarton F., Mezzavilla F., Verza E. (eds.) (2013a) – Le Garzaie in Veneto. Risultati dei censimenti svolti nel 2009-2010. Associazione Faunisti Veneti, Quaderni Faunistici – n. 2. 224 pagg.
Scarton F., Cecconi G., Cerasuolo C., Valle R. (2013b) – The importance of dredge islands for breeding waterbirds. A tree-year study in the Venice Lagoon (Italy). Ecological Engineering, 54: 39-48.
Scarton F., Valle R. (2015) – Long-Term Trends (1989-2013) In the seabird community breeding in the lagoon of Venice (Italy). Rivista Italiana di Ornitologia – Research in Ornithology, 85:21-30.
Scarton F., Valle R. (2017) – Andamento recente (2013-2015) delle popolazioni di uccelli acquatici nidificanti nella laguna aperta di Venezia. Boll. Mus. civ. St. nat. Venezia, 67: 113-123.
Scarton F., Baldin M, Valle R. (2009) – Distribuzione e consistenza della pettegola Tringa totanus nidificante nelle barene della laguna aperta di Venezia. Anni 2001- 2006. Boll. Mus. civ. St. nat. Venezia, 59: 117-126.
Scarton F., Bon M., Trebbi O. (2017) – Importanza di un impianto di fitodepurazione per l’avifauna acquatica nidificante e svernante. Il caso di una Cassa di colmata (Mira, Venezia, Italia settentrionale). Rivista Italiana di Ornitologia – Research in Ornithology, 87: 9-14.
Scarton F., Verza E., Guzzon C., Utmar P., Sgorlon G., Valle R. (2018) – Laro-limicoli (Charadriiformes) nidificanti nel litorale nord adriatico (Veneto e Friuli- Venezia Giulia) nel periodo 2008-2014: consistenza, trend e problematiche di conservazione. Rivista Italiana di Ornitologia – Research in Ornithology, 88: 33-41.
Scarton F., Sighele M., Stival E., Verza E., Bedin L., Cassol M., Crivellari C., Fioretto M., Guzzon C., Maistri R., Mezzavilla F., Pedrini P., PirasG., Utmar P., Volcan G. (2019) – Risultati del censimento delle specie coloniali (Threskiornithidae – Ardeidae – Phalacrocoracidae) nidificanti nel Veneto e nelle province di Trento e Bolzano. Anno 2017. Internet: www.birdingveneto.eu/garzaie/garzaie.html
Schreiber E.A., Burger J. (Eds.) (2002) − Biology of Marine Birds. CRC Press, Boca Raton, Florida. 722 pp.
Stolen E. D., Breininger D.R., FrederickP.C. (2004) – Using waterbirds as indicators in estuarine systems: successes and perils. In Bertone M. (ed.), Estuarine indicators. CRC Press: 431-444.
Valle R., Scarton F. (2018) – Uso dei droni nel censimento degli uccelli acquatici nidificanti nel Nord Adriatico. Boll. Mus. civ. St. nat. Venezia, 69: 69-75.
Valle R. G., Scarton F. (2020) – Drones improve effectiveness and reduce disturbance of censusing Common Redshanks Tringa totanus breeding on salt marshes. Ardea, 107: 275-282.
VořišekP., Klvaňova A., Wotton S., Gregory R. D. (eds.) (2008) – A best practice guide for wild bird monitoring schemes. First edition, CSO/RSPB.

