Riassunto
Una dettagliata rassegna delle ricerche pregresse sulle microalghe della laguna di Venezia ha consentito di stilare un elenco (in ordine alfabetico nell’ambito di ogni classe) delle specie, sia planctoniche che bentoniche, rinvenute nelle acque veneziane a partire dagli inizi del secolo XX, citando di volta in volta gli Autori di ogni singola segnalazione. In particolare, si è prestata parti-colare attenzione alla nomenclatura di diatomee e dinoflagellate che nel tempo, a seguito del pro-gresso delle metodiche d’indagine, è stata oggetto di numerosi rimaneggiamenti e aggiornamenti, con conseguente aumento delle sinonimie sulla base di nuovi principi tassonomici. Nell’ambito di ogni classe si sono evidenziati quei taxa (generi e specie) che in seno alle comunità lagunari si sono rivelati particolarmente significativi dal punto di vista sia qualitativo che quantitativo. Il la-voro è completato da una serie di tavole di fotografie eseguite in prevalenza mediante l’ausilio del microscopio elettronico a scansione, che permette di mettere meglio in luce i caratteri strutturali degli organismi esaminati e quindi di facilitarne il riconoscimento tassonomico.
Abstract
Synopsis of the microalgae of the Venice lagoon
After a detailed review of previous researches on the microalgae of the Venice lagoon, a list was related in alphabetical order of the species, whether planktonic or benthic, found in the lagoon since the beginning of the twentieth century. Every time the authors of the findings were quoted. Regarding diatoms and dinoflagellates, particular attention has been given to the taxa nomencla-ture, which, thanks to the new study methods, has undergone several adjustments and revisions following new methods of study. For each class, the most qualitatively and quantitatively significant taxa (genus and species) within the lagoon communities were highlighted. The work is completed with a series of photos mostly obtained at the scanning electronic microscope, allowing to better emphasize the structural features of the investigated organisms, hence making easier the taxonomi-cal identification.
Premessa
La laguna di Venezia (Fig. 1) rappresenta di fatto uno dei sistemi costieri più interessanti e peculiari esistenti: la sua estensione (oltre 550 km2) e soprattutto la sua struttura geomorfologica e idrologica ne fanno un laboratorio naturalisti-co unico, valorizzato e ampiamente studiato dal punto di vista scientifico solo negli ultimi decenni.
Anche le ricerche sulle microalghe hanno risentito di questo sempre maggiore interesse, che mescola obiettivi meramente conoscitivi o conservazionistici a finalità socio-economiche.
La possibilità di redigere una lista floristica comprendente tutte le entità mi-croalgali segnalate nel corso degli anni nelle acque della Laguna di Venezia, completando e perfezionando analoghi tentativi effettuati in passato (Tolomio, 1978), è stata in buona parte condizionata non solo dall’evoluzione, talora poco comprensibile, della nomenclatura tassonomica, ma anche dalle variazioni so-stanziali sia nei metodi di raccolta e di studio che nel progresso tecnologico dei sistemi d’indagine.
Non è lecito peraltro operare confronti tra elenchi floristici redatti in epoche tanto lontane ma solo prenderne atto, cercando di evidenziare per quanto pos-sibile affinità o discordanze nell’identificazione delle varie entità.
Resta tuttavia un altro problema di non poco conto, vale a dire l’esperienza e la soggettività di chi esamina i campioni, per cui si possono avere differenze rilevanti, sia qualitative che quantitative, anche nel caso di analisi simultanee di uno stesso campione da parte di due distinti operatori.
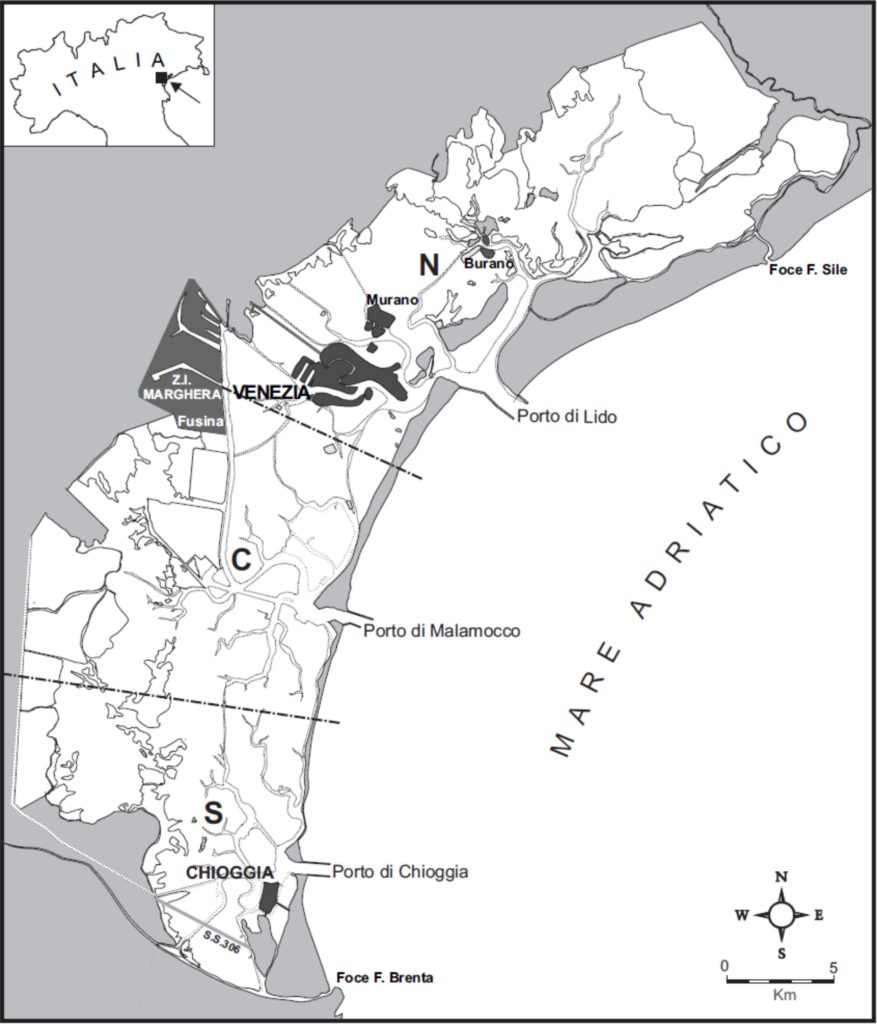
bacini (N = nord; C = centro; S = sud), sono stati individuati sulla base di rilievi erofotogrammetrici delle correnti di marea in superficie (D’Alpaos & Di Silvio, 1979).
Generalità sul fitoplancton e sul microfitobentos lagunare
La laguna, in quanto sistema di transizione (Sacchi, 1995), costituisce per le comunità biologiche, comprese quelle planctoniche soggette passivamente al trasporto delle correnti tidali, un ambiente di marcata selezione (D’Ancona & Battaglia, 1962) in grado di alterare profondamente la struttura dei popola-menti che vi vivono, oltre ad indurre cambiamenti morfo-genetici a livello dei singoli organismi. Ciò comporta l’insorgere di vere e proprie “forme ecologiche” quale conseguenza delle particolari condizioni che caratterizzano in gene-re le acque salmastre. Molte incertezze nella definizione sistematica derivano proprio da un siffatto condizionamento e di ciò si deve tenere conto nell’esame e nell’interpretazione dei dati emersi nel corso delle ricerche effettuate in que-sto tipo di ambienti.
Il fitoplancton lagunare merita comunque alcune osservazioni di principio, le-gate innanzitutto alle particolari condizioni che contraddistinguono l’ambiente (Tolomio, 2002). “Eterogeneità e instabilità sono le caratteristiche basilari di questi euriecosistemi, che non di rado si presentano come un composito mo-saico di microambienti, in cui si inseriscono in una continuità sia temporale che spaziale popolamenti animali e vegetali. Questi organismi, coinvolti nella dinamica complessiva del mezzo, pur presentando un ampio adattamento eco-fisiologico, non sono esenti però da limiti ben precisi” (Tolomio, 1976a), il che implica rilevanti variazioni, sia qualitative che quantitative, in seno alle diverse comunità lagunari. Il complesso idrodinamismo del bacino veneziano porta a contatto e quindi a mescolarsi di popolamenti di diversa origine e provenienza in un gioco spesso imprevedibile di equilibri ritmici. Le maree, con il loro flusso e riflusso, sembrano dominare il quadro d’insieme, condizionando l’evoluzione di tutti i parametri fisico-chimici delle masse d’acqua coinvolte. La componen-te marina traslata in laguna subisce progressivamente l’impatto di variazioni derivanti dalla mescolanza di corpi idrici tra loro fortemente differenziati: ne subiscono le conseguenze dapprima le forme “oceaniche”, vale a dire quelle di mare aperto, meno tolleranti nei confronti delle nuove condizioni ambientali (stenoecie); successivamente una certa regressione si può avere anche tra le for-me neritiche, che tuttavia, in quanto costiere, presentano una più ampia valenza ecologica (euriecie). Tra queste vanno ricercate quelle entità che, a torto o a ragione, possiamo definire “salmastre”, anche se il termine non sembra corri-spondere alla realtà, visto che tali organismi difficilmente sono esclusivi di que-sti ambienti. In laguna non mancano però taxa tipicamente dulcicoli, traspor-tati dalle acque degli immissari perimetrali o dalle acque di dilavamento, che in particolari situazioni climatiche possono affluire abbondanti all’interno del bacino. Questa componente, tuttavia, mostra una presenza contingente e circo-scritta nello spazio in quanto, una volta giunta all’interno dell’invaso lagunare, è destinata a regredire in maniera rapida e irreversibile e ciò principalmente per due motivi: il trasporto del potamoplancton è unidirezionale e, per la ricono-sciuta minore tolleranza nei confronti delle variazioni del mezzo-ambiente, le specie oligoalobie hanno una adattabilità alquanto ridotta (Tolomio, 1983-84). In effetti, “il fitoplancton in laguna è costituito per la quasi totalità da specie accompagnatrici, comuni cioè ad altri biotopi, vale a dire ubiquiste, o da specie accidentali, presenti queste ultime in numero limitato e sporadicamente” (To-lomio, 1976a). Il mantenimento e lo sviluppo delle comunità microalgali che contribuiscono alla produzione primaria di un bacino lagunare sono peraltro condizionati da un insieme di fattori che esplicano la loro azione in maniera ora cumulativa, ora antagonista, ora interferente. Solo occasionalmente, grazie a particolari condizioni favorevoli, si sono registrate “fioriture” di certe specie in seno all’invaso, ma non per questo è lecito considerare tali organismi pretta-mente salmastri. Se è vero che la barriera ecologica è costituita principalmente dalla salinità, che esercita un’azione preponderante sul metabolismo della mag-gior parte delle microalghe che si ritrovano in laguna, è altrettanto vero che in ogni comunità ivi presente non si possono trascurare altri fattori (biotici e climatici, oltre che nutrizionali) che interagiscono in maniera talvolta determi-nante (Tolomio, 1977a).
In conclusione, pur ribadendo l’inesistenza di specie “caratteristiche”, esclu-sive cioè dell’ambiente salmastro, si deve tuttavia ammettere che le comunità fitoplanctoniche nelle acque mixoaline siano strutturalmente ben diverse da quelle che si trovano in mare o nelle acque dolci e rappresentino il risultato di un equilibrio instabile e complesso tra corpi idrici che si avvicendano e si con-trappongono anche in spazi e tempi relativamente circoscritti in un processo d’incessante mutazione.
Considerazioni analoghe si possono trarre anche per tutte quelle microalghe che hanno rapporti con il fondo, sia esso “duro in posto”, sia esso mobile, ovviamente considerato che gli organismi non vivono più in acque libere, soggetti passivamente agli spostamenti del mezzo, ma sono relegati a svolgere le loro attività vitali in un sito alquanto circoscritto, con cambiamenti ancora più rilevanti relativamente alle condizioni ambientali a causa delle corren-ti di marea. A ciò si aggiunga l’influenza del tipo di substrato: per quelli duri si dovrà tener conto della struttura fisica e della composizione chimica, per quelli mobili della granulometria e della stabilità dei sedimenti stessi. In quest’ultimo caso poi si aggiunga il fatto che le diatomee, frazione prepon-derante del microfitobentos, sono in grado di effettuare movimenti, ampia-mente dimostrati nelle rafidee (Bertrand, 1992), che consentono anche di penetrare negli interstizi fino a qualche centimetro di profondità. In questo caso può essere determinante anche la disponibilità di energia luminosa che in ambiente lagunare, anche in caso di modesta profondità, può diventare fo-tosinteticamente limitante in ragione del particellato in sospensione sempre abbondante.
Oltre alle diatomee, tra gli organismi “colonizzatori” dei vari tipi di substrato, si devono annoverare le cianoficee, che con le loro forme coloniali più adatta-bili possono risultare competitive nei confronti delle altre microalghe sino ad escluderne la presenza.
In generale possiamo quindi ritenere che i microrganismi fotoautotrofi che ca-ratterizzano le acque lagunari possano essere oggetto anche in futuro di studi che difficilmente risulteranno ripetitivi rispetto a quelli pregressi, ancor più in quest’ambiente che sembra, sia per la configurazione geomorfologia, sia per le peculiarità intrinseche, sia per l’impatto antropico, ben più variabile a breve e medio termine rispetto all’ecosistema marino antistante.
Studi pregressi sul fitoplancton e sul microfitobentos lagunare
Le microalghe planctoniche
Periodo: da inizio ’800 a metà ’900
Se si escludono alcune frammentarie segnalazioni di microalghe lagunari da parte di Martens (1824), di Naccari (1828) e di Zanardini (1847), le prime notizie sul fitoplancton delle acque veneziane risalgono all’ultimo quarto del sec. XIX. Imhof, nell’ottobre del 1886, eseguì alcuni campionamenti, tramite retino, in Canal Grande, nel porto del Lido e in quello di Chioggia: oltre alla segnalazione di protozoi, di tintinnidi e di larve di molluschi, fu evidenziata l’occasionale presenza, con evidente variabilità morfologica, di alcuni dinofla-gellati, in particolare di specie appartenenti al genere Ceratium, i cui caratteri tassonomici furono confrontati con quelli allora conosciuti in letteratura. Sul finire del secolo De Toni (1898) pubblicò una flora riguardante le alghe “della Venezia”, in cui venivano citate 23 specie di diatomee lagunari.
Ma è a partire dai primi decenni del novecento che gli studi sul plancton cominciarono ad essere più frequenti e finalizzati.
Nel 1912 Carazzi e Grandori, analizzando campioni raccolti presso il Faro Rocchetta (Malamocco) e lungo il canale prossimo a Valle Figheri, classifica-rono 48 specie di Bacillariacee (diatomee) e 16 specie di Peridinee (dinoflagel-late); i suddetti Autori evidenziarono una diversa distribuzione e abbondanza di microalghe nelle due aree esaminate (la prima di “laguna viva”, la seconda di “laguna morta”), avanzando anche alcune ipotesi sulla comparsa di episodi di “mare sporco”, imputabili soprattutto alle diatomee, in particolare al genere Chaetoceros, mentre appariva del tutto trascurabile il ruolo delle dinoficee.
Pescate effettuate da Migliardi O’Riordan (1915) a S. Nicolò di Lido, utiliz-zando una rete di Apstein, consentirono di identificare 118 specie planctoniche di cui 93 appartenenti al fitoplancton e 25 allo zooplancton. A quest’ultimo peraltro venivano attribuiti anche generi come Ceratium, Dinophysis e Peridi-nium, di cui non erano ancora note le capacità di autotrofia tipica degli orga-nismi vegetali. Successivamente lo stesso Autore (1925) decise di affrontare il problema dell’adattamento del plancton alle particolari condizioni ambientali eseguendo campionamenti con retino in due aree alquanto diverse e lontane tra loro: bacino di Chioggia (settembre 1921) e canali di grande navigazione in prossimità della città di Venezia (dicembre dello stesso anno). Delle varie forme segnalate, 89 sono state rinvenute nella “laguna viva”, 68 in quella “intermedia” (costituita cioè dai profondi canali tra laguna “viva” e laguna “morta”) e 28 nella “laguna morta”.
Teodoro, nel 1925, pubblicò i risultati di studi sui dinoflagellati della laguna veneta, raccolti nel 1921, sottolineando la diversa distribuzione delle 27 specie rinvenute e constatando l’inesistenza di forme esclusive della laguna dal mo-mento che tutte le specie identificate erano presenti anche in mare.
Più esaurienti si rivelarono gli studi effettuati da Zanon (1937, 1938), che esa-minò ben 300 campioni provenienti da raccolte di plancton, lavaggio di alghe e materiale di fondo. Furono individuate, tra specie e varietà, 497 diatomee, di cui 286 mai segnalate nella Laguna di Venezia e 112 mai rinvenute neppure in Adriatico. Questa “florula” comprendeva forme sia marine che d’acqua dolce, sia planctoniche che bentoniche, a seguito della grande eterogeneità dei saggi esaminati, provenienti tra l’altro da zone soggette a tipi diversi di idrodina-mismo e conseguentemente caratterizzate da condizioni ambientali del tutto peculiari e differenziate.
Nell’ambito delle attività della Delegazione Italiana presso la Commissione In-ternazionale per l’Esplorazione Scientifica del Mediterraneo, Issel (1941) pub-blicò i risultati di studi effettuati nel 1929, 1930 e 1931 sul plancton della Laguna Veneta: vennero segnalate 30 diatomee e 40 peridinee, oltre ad una decina di tin-tinnidi e ad altre forme zooplanctoniche. In questo lavoro si dimostrò peraltro l’azione selettiva da parte delle acque lagunari e s’intuì la funzione delle correnti adriatiche nel trasporto verso nord del plancton presente nel Mediterraneo.
Periodo: da metà ’900 a fine secolo
A metà del sec. XX° il bacino di Chioggia fu oggetto di una serie di ricerche alquanto approfondite riguardanti sia l’idrografia (Faganelli, 1954), sia lo zoo-plancton (Ranzoli, 1954), sia il fitoplancton (Marchesoni, 1954). Quest’ultimo Autore studiò, sia qualitativamente che quantitativamente, i cicli stagionali del-la componente vegetale del plancton in oltre 500 campioni prelevati in stazioni lagunari e litoranee da luglio 1947 a novembre 1948. Furono identificate 219 diatomee e 71 peridinee, oltre ad alcune coccolitine e silicoflagellate. Fu indivi-duata una fase a diatomee, dall’autunno alla primavera, e un periodo di svilup-po delle peridinee, presenti prevalentemente da luglio a settembre. Fu ribadita l’inesistenza di un fitoplancton prettamente lagunare ed evidenziati i fenomeni di selezione e regressione delle specie che penetrano in laguna, con conseguente riduzione del carico microalgale in fase di riflusso.
Ma talora specie che bene si adattano alle condizioni che si ritrovano in lagu-na possono dar luogo a proliferazioni massive. Voltolina (1970) segnalò una fioritura di due diatomee (Skeletonema costatum e Nitzschia seriata) e di una euglenoficea (Eutreptiella pascheri) verificatasi nell’aprile 1970; nella primavera dell’anno successivo si ripeté il fenomeno a carico di Skeletonema costatum, Eutreptiella pascheri e Pyramimonas cruciata (cloroficee) e di alcuni flagellati nonmeglio identificati (Voltolina, 1973a, 1973b). Lo stesso Voltolina, tra dicem-bre 1969 e novembre 1970, condusse ricerche sull’idrologia e sul fitoplancton in una stazione situata all’imboccatura del porto-canale di Malamocco (Vol-tolina 1973c). Sulla base delle ricerche precedenti, Voltolina (1974) mise in luce il ruolo dei nutrienti soprattutto in occasione delle fioriture, che possono verificarsi anche nelle zone lagunari più interne, favorite, oltre che dall’elevato trofismo, anche dal ristagno idrico. Successivamente furono pubblicati i dati relativi alla composizione qualitativa, alla distribuzione spaziale e alle variazioni stagionali del fitoplancton stagionale, raccolto da novembre 1971 a novembre 1972 in 19 stazioni scelte al fine di offrire un quadro sufficientemente rappre-sentativo delle situazioni riscontrabili in laguna durante le fasi di deflusso (Vol-tolina, 1975a).
Nel 1981 Socal rese noti i risultati di uno studio sulla distribuzione quantitati-va del fitoplancton nel bacino settentrionale della laguna. Egli evidenziò come la biomassa fitoplanctonica presenti un evidente andamento stagionale, come essa risulti più abbondante nelle aree idrologicamente più attive e come la sua distribuzione verticale sia rapportabile alla struttura termoalina della colonna d’acqua, più differenziata durante le fasi di quadratura allorché si ha una mino-re turbolenza e quindi un più limitato rimescolamento.
Lo stesso Socal, assieme a Ghetti, Boldrin e Bianchi, nel 1985 pubblicò uno studio sul fitoplancton del porto-canale di Malamocco. In tale lavoro fu messo in evidenza il ruolo dei microflagellati nel corso di tutto l’anno, l’abbondanza delle diatomee con specie tipicamente neritiche nella stagione calda, e la preva-lenza dei dinoflagellati nelle acque entranti a testimonianza della loro talassoge-nia; nonostante la profondità, in corrispondenza della stazione esaminata non furono riscontrate stratificazioni nella colonna d’acqua.
Una certa attenzione fu dedicata, a partire dagli anni ottanta, alle comunità fi-toplanctoniche presenti in zone di aperta laguna destinate alla mitilicoltura o in specchi d’acqua arginati, da molto tempo utilizzati a Venezia per l’allevamento di specie ittiche pregiate. Nel primo caso, relativamente al bacino di Chioggia, sono da citare i lavori di Socal et al. (1986) (71 taxa rinvenuti tra cui 54 Dia-tomee) e di Tolomio et al. (1996); in quest’ultimo lavoro, nell’arco di due anni (1991 e 1992), furono individuati in totale 212 taxa (di cui ben 163 diatomee) ed evidenziate quelle forme che maggiormente contribuiscono alla produttività delle acque lagunari. Nel secondo caso vanno inquadrate invece le numerose ricerche effettuate in alcune valli da pesca localizzate nei settori nord e sud della laguna (Andreoli &Tolomio, 1985, 1988a, 1988 b; Andreoli et al., 1986): in questi ambienti del tutto particolari la selezione è alquanto marcata e il nume-ro di specie tende a diminuire, anche se spesso alcune forme possono avere una rilevante presenza quantitativa (in Valle Dogà Gymnodinium sp. nel 1983 e Thalassionema nitzschioides e Cylindrotheca closterium nel 1984/85; in Valle Fosse Chlorella nana nel 1984 e Gymnodinium splendens ed Eutreptiella marina nel 1985; in Valle Sparesera (1984) Skeletonema costatum, Nitzschia closterium, Prorocentrum miniumum e Chlorella nana; in Valle Zappa (1985) Skeletonema costatum e Nitzschia closterium).
Con finalità di un recupero ambientale ai fini della piscicoltura fu studiato, con cadenza stagionale, a partire da giugno 1980 fino a marzo 1982, anche il settore più meridionale della laguna (Valle di Brenta), rimasto idrologicamente isolato a seguito della costruzione di un terrapieno su cui scorre la strada statale n. 306 (Tolomio, 1988). La microflora è risultata ricca e composta da 230 taxa fitoplanctonici, tra cui dominano in tutte le stagioni le diatomee, mentre dino-ficee e cloroficee diventano significative solo d’estate; sempre presenti risultano i microflagellati (ivi non meglio definiti) che raggiungono in qualche occasione densità anche elevate.
La distribuzione del fitoplancton lungo i canali navigabili che si addentrano in laguna può risentire delle variazioni del gradiente salino o di altre caratteristi-che ambientali. Così Cioce et al. (1979) evidenziarono il ruolo delle maree su salinità, temperatura, ossigeno, nutrienti e densità dei popolamenti planctonici in tre stazioni (una costiera, una intermedia e una lagunare più interna) nel bacino nord della laguna, confrontando i risultati con quelli ottenuti in prece-denza. Socal et al. (1987) studiarono, nel febbraio 1983, la densità e la diversità specifica dei popolamenti microalgali (costituiti complessivamente da 73 taxa identificati) in 14 stazioni distribuite lungo la via d’acqua che collega la bocca di porto di Lido alla foce del fiume Dese e del canale Silone (bacino nord). Infine Tolomio (1993) ha sottolineato la funzione delle correnti di marea e quindi della salinità sulla struttura delle comunità fitoplanctoniche (oltre 200 i taxa rinvenuti) presenti nelle acque del Canale delle Trezze che alimentano la Valle di Brenta (bacino sud).
In tempi recenti ha assunto grande interesse il controllo dell’impatto degli in-terventi antropici in corrispondenza della conterminazione lagunare, in parti-colare nell’area industriale di Porto Marghera. I versamenti delle acque calde provenienti dalle turbine di raffreddamento della centrale termoelettrica di Fu-sina sono stati studiati sulla base di un piano sperimentale atto a monitorare tut-ta l’area antistante gli scarichi, anche per quanto concerne la componente fito-planctonica (Commissione tecnico-scientifica, 1983; Socal et al., 1989, 1999).
D’altro canto esistono alcune componenti del fitoplancton lagunare che posso-no risentire di tali alterazioni ambientali come, ad esempio, la diatomea Skele-tonema costatum (Alberighi et al., 1992;Moschin& Moro, 1996) o essere diprovenienza alloctona, anche remota, come Coolia monotis (Tolomio & Cavo-lo, 1985a) o Bellerochea malleus f. biangularis (Tolomio & Moschin, 1994). Sulla base di quest’ultima possibilità e in considerazione dell’impatto che l’ap-porto e la presenza di specie tossiche possono avere nei confronti delle attività alieutiche o dell’acquacoltura, nel corso di un lungo periodo (1988-1993) si sono presi in considerazione un migliaio di campioni al fine di operare un con-trollo al riguardo, controllo che si è rivelato sostanzialmente negativo (Tolomio & Moschin, 1995a). Anche ricerche posteriori hanno avvalorato la tesi che la scarsa abbondanza in laguna di cellule appartenenti a specie potenzialmente tossiche, se si esclude in qualche caso Prorocentrum cordatum (ex minimum) (Ost.) Dodge, non ha effetti sull’ambiente e sugli organismi che vi vivono (pesci e molluschi) e quindi alcuna conseguenza sulla salute umana e sugli interessi socio-economici locali (Tolomio, 2008; Facca et al., 2014a).
Del resto in laguna sono state individuate anche specie nuove, sia tra le diato-mee come Thalassiosira annaliae (Voltolina, 1975b) che tra le dinoficee, come Prorocentrum venetum (Tolomio& Cavolo, 1985b), confermando quanto que-sto ambiente sia favorevole all’insorgenza di entità tassonomiche geneticamente differenziate.
Periodo: dal 2000 in poi
Nell’ambito di un vasto programma di ricerche avviato alla fine del secolo scor-so in molteplici settori (Progetto Sistema Lagunare Veneziano), si sono svolti studi riguardanti l’aggiornamento della microflora pelagica della laguna, non-ché la distribuzione e la stima quantitativa delle comunità microalgali in zone la-gunari caratterizzate da un diverso idrodinamismo. Si tratta d’indagini eseguite nel corso di cicli annuali successivi, operando nello stesso momento in stazioni lontane tra loro al fine di poterne confrontare i risultati ottenuti nelle medesime condizioni di marea, sia entrante che uscente (Tolomio et al., 2000 a). In un primo ciclo si sono prese in esame due stazioni nel bacino settentrionale (164 taxa di cui 118 diatomee e 34 dinoficee) e due in quello meridionale (202 taxa di cui 148 diatomee e 45 dinoficee) in corrispondenza delle rispettive bocche di porto (Tolomio et al., 1999b). Quantitativamente le acque a nord sono risul-tate più ricche in fitoplancton rispetto a quelle a sud; oltre alle consuete forme eupelagiche, più frequenti in fase di flusso (Chaetoceros spp., Rhizosolenia spp., Cerataulina pelagica, Leptocylindrus danicus, Thalassiothrix mediterranea), sonostate segnalate diverse specie ticopelagiche, in particolare Amphora exigua, A. veneta, Cocconeis molesta, C. scutellum, che si ritrovano abbondanti anche nelmicrofitobentos dei sedimenti di fondo (Tolomio et al., 1999a; Tolomio et al., 2002a; Tolomio, 2004b). In un secondo ciclo è stato studiato il bacino centrale (Tolomio et al., 2006), con stazioni distribuite dalla bocca di porto verso la zona industriale di Porto Marghera: globalmente si sono individuati 265 taxa, ancora con netta prevalenza delle diatomee (198) rispetto alle dinoficee (48); in ogni caso il rapporto tra il numero di specie appartenenti a queste due classi tende ad aumentare progressivamente verso l’interno, come riscontrato in altri bacini lagunari (Tolomio, 1977b). Sempre nel bacino centrale è stato eseguita anche un’indagine stagionale in una serie di stazioni fissate lungo i canali che ne caratterizzano la rete idroviaria: Canale di S. Pietro, C. di Valgrande, C. Cornio, C. Rocchetta, C. Campana, C. Melison (Tolomio & Moschin, 2006) Nel terzo ciclo si è considerato il versante interno dell’Isola di Pellestrina (Tolomio & Moschin, 2007) e una zona a ridosso dell’abitato di Chioggia, in corrispon-denza della biforcazione del Canale Lombardo (Tolomio, 2007). Nel primo caso, l’area, pur apparendo logisticamente poco influenzata dalle correnti di marea, risulta caratterizzata da comunità fitoplanctoniche (in totale 186 taxa) costituite in buona parte da elementi ad affinità marina; nel secondo caso si sono evidenziate anomalie, sia a livello dei popolamenti fitoplanctonici che a livello delle condizioni ambientali, dovute alle particolari caratteristiche idrodi-namiche, tutt’altro che schematizzabili, e all’influenza degli scarichi del vicino agglomerato urbano.
In tutti i casi esaminati è apparso comunque evidente come la direzione della corrente, nonché il momento di marea, assumano un ruolo importante nei con-fronti del fitoplancton. Sulla base di una siffatta problematica le variazioni della composizione e dell’abbondanza del fitoplancton sono state studiate nel corso di cicli di marea dall’alba al tramonto, con cadenza stagionale per un biennio (da giugno 1990 a marzo 1992), in due stazioni site in corrispondenza delle boc-che della Valle di Brenta (Canale delle Trezze e Canale Lombardo) (Tolomio et al., 2005). Molto ricca e varia è risultata la microflora planctonica, costituitada 251 entità, di cui 157 diatomee, mentre dinoficee, euglenoficee e clorofi-cee contribuiscono in modo pressoché simile alla composizione delle comunità presenti. In ogni caso i risultati hanno confermato la relazione tra idrodinami-smo e fluttuazioni del contenuto fitoplanctonico, anche se talora eventi non prevedibili hanno eluso le aspettative. Analogo lavoro era stato svolto durante un ciclo tidale, nella palude di Cona (bacino settentrionale) (Barillari et al., 1985): assieme alle variabili idrologiche, era stato analizzato, con frequenza di 90 minuti, l’andamento della biomassa fitoplanctonica in rapporto alla corrente e al profilo della colonna d’acqua. In particolare, la comunità microalgale era apparsa rappresentata per l’80-90% da diatomee pennate, dulcicole o larga-mente eurialine. L’indice di diversità risentiva nel tempo delle diverse fasi tidali: assai basso in fase di riflusso allorché la comunità era costituita per il 99% da Nitzschia sp., più alto in marea entrante quando l’aumento della salinità com-portava anche un aumento del numero di specie con comparsa di molte forme neritiche (i.e., Thalassiosira minima, Leptocylindrus danicus).
Ancora più significativi al riguardo si sono rivelati i risultati ottenuti da prelievi eseguiti a breve scala temporale (3 ore circa), durante 24 ore (cicli nictemerali), in stagioni diverse (Tolomio et al., 2004-2007). Il sito di raccolta prescelto, no-nostante la prossimità al centro storico di Chioggia, ha manifestato una marcata affinità con l’ambiente marino grazie alla vicinanza con la bocca di porto, il che, in seno alle comunità fitoplanctoniche costituite complessivamente da 113 entità tassonomiche di cui 83 diatomee e 25 dinoficee, ha determinato una pa-lese prevalenza di forme tipicamente eualobie. Anche in questo caso la ciclicità delle caratteristiche idrologiche e del contenuto biologico è stata talora alterata da anomalie idrodinamiche o da eventi contingenti, difficilmente prevedibili.
Si sono svolte anche indagini sulle variazioni di contenuto biologico (fitoplan-cton) in corpi idrici prima sospinti verso le zone lagunari interne e successiva-mente defluenti (Tolomio et al., 2002c) oppure fluitati, attraverso le bocche di porto, verso il mare aperto (Tolomio, 2003): nel primo caso, in cui si sono considerate quattro stazioni distribuite lungo i canali Poco Pesce-Novissimo se-condo un gradiente alino decrescente, si è osservata la consueta azione selettiva operata sugli organismi (150 taxa in totale di cui 107 diatomee e 31 dinoficee) da parte delle acque commiste, con una conseguente regressione quantitativa soprattutto in corrispondenza delle zone più interne; nel secondo caso, le stazio-ni disposte a ventaglio di fronte al porto-canale di Chioggia, hanno evidenziato il ruolo che gli apporti alloctoni possono assumere nella composizione e nella densità dei popolamenti planctonici, nel caso specifico costituiti da 123 unità tassonomiche, in prevalenza diatomee (81), ma caratterizzati in certi periodi da una presenza significativa di microflagellate, costituite da forme di dimensioni inferiori a 6 μm, con oltre il 60% del numero totale delle cellule rinvenute.
Le grandi variazioni, spesso a breve termine, cui è soggetto il fitoplancton del-la laguna, ha indotto ad effettuare uno studio con cadenza giornaliera per la durata di un anno (aprile 1993-marzo 1994) in una stazione prossima al centro storico di Chioggia (Tolomio & Bullo, 2001a): l’esame di oltre 500 campioni, raccolti in fasi opposte di marea, ha mostrato come la composizione dei popola-menti (per un totale di 236 entità), anche in questo caso, risenta costantemente dell’apporto di elementi di origine marina (diatomee eupelagiche, dinoficee, primnesioficee) e solo occasionalmente di elementi oligoalobii, per lo più legati a versamenti d’immissari (diatomee dulcicole) o ad acque di rifiuto (euglenofi-cee). Considerevoli variazioni si sono osservate anche nel caso delle forme più diffuse a testimonianza che i ritmi tidali giocano un ruolo ben più importante delle stesse condizioni ambientali a livello climatico.
Quasi contemporanea è una ricerca di carattere prevalentemente tipologico su 225 campioni raccolti con retino nelle acque del bacino meridionale della lagu-na (5 stazioni) nel corso di due anni (gennaio 1993-dicembre 1994) (Tolomio et al., 2002 b). Scopo del lavoro era un aggiornamento delle conoscenze sullatipologia dei popolamenti fitoplanctonici di questo settore lagunare: sono stati individuati oltre 300 taxa per lo più costituiti da diatomee (215) e, secondaria-mente, da dinoficee (73).
Parimenti di carattere qualitativo risulta essere un’indagine a cadenza mensile (marzo 1995-giugno 1996) sul fitoplancton presente in tre stazioni, di cui una lungo il litorale, di fronte alla foce del fiume Brenta, una all’interno dell’inva-so lagunare (alla confluenza dei canali di Caroman, di Bombae e di Pellestri-na) e una in corrispondenza del porto-canale di Chioggia (Tolomio & Bullo, 2001b). Il confronto tra i risultati ottenuti nelle stazioni esaminate (in cui il rapporto diatomee/dinoficee è comunque pari a 2 o superiore, con un numero di entità complessivamente elevato, maggiore di 180) ha evidenziato differen-ze imputabili alla diversa circolazione idrica, anche se in laguna non mancano elementi eupelagici e verso il mare si possono ritrovare frequentemente forme dulcicole o quanto meno oligoalobie.
Quasi contemporaneamente (novembre 1994 – settembre 1995) è stata effet-tuata un’altra ricerca in tre stazioni nel bacino di Chioggia, in prossimità del porto-canale, con lo scopo di caratterizzare l’entità e la composizione dei popo-lamenti fitoplanctonici in rapporto ad alcune variabili (posizione delle stazioni, profondità dei prelievi, fase di marea, stagionalità), il tutto in funzione di una successiva analisi multivariata in grado di fornire un’interpretazione probabi-listica nella descrizione del sistema lagunare (Tolomio et al., 2009). Quanto emerso dallo studio di 144 campioni biologici e di 1488 dati ambientali e dalla successiva elaborazione statistica di tutti i risultati ha consentito di trarre utili indicazioni a livello metodologico circa l’impostazione delle campagne di ricer-ca in ambienti tanto peculiari e tanto soggetti ad una forte variabilità a breve termine. È tuttavia da rilevare come qualitativamente le comunità siano risul-tate meno ricche e differenziate (90 entità complessivamente con 71 diatomee e 15 dinoficee) rispetto a quanto rilevato in precedenza o in seguito, il che è in buona parte attribuibile alla diversa metodica di campionamento.
In seguito, nel 1997, limitatamente ad una stazione fissata sul versante nord dell’Isola di San Domenico (Chioggia), si è voluta studiare l’influenza delle ma-ree di sizigia e di quadratura sulle comunità fitoplanctoniche, considerando le acque di flusso e di riflusso nel corso di prelievi effettuati settimanalmente da gennaio a dicembre (Tolomio & Bullo, 2001c). Netta la prevalenza, in seno alle diatomee (117 entità), delle forme ticopelagiche, che grazie al vivace idrodi-namismo possono passare facilmente dal dominio bentonico a quello pelagico, contribuendo talora ad un incremento della quantità di cellule presenti nelle acque uscenti. Ancora una volta alquanto scarsa si è rivelata la presenza di dino-ficee (22 entità), anche nella stagione calda, solitamente a loro propizia, mentre nell’ambito dell’abbondanza del fitoplancton importante è apparso in alcune occasioni il ruolo dei microflagellati.
Tale ricerca è proseguita con le medesime modalità per altri quattro anni (dal 1998 al 2001) con lo scopo di analizzare la ciclicità delle comunità fitoplan-ctoniche in annualità esaminate in successione (Tolomio & Bullo, 2006). In effetti si sono registrate differenze talora significative tra un anno e l’altro, sia nei valori totali di abbondanza sia nella presenza delle singole specie, comprese quelle più diffuse. Peraltro, nonostante il periodo piuttosto prolungato della ricerca, il numero di taxa non è risultato particolarmente elevato (in totale 170 entità), con le diatomee, come sempre, dominanti (121 entità) e presenti con molte specie (44) nell’arco di tutto il periodo considerato.
Uno studio con cadenza stagionale è stato svolto nel bacino settentrionale in due stazioni localizzate rispettivamente presso l’isola di Carbonera e presso l’isola di Campalto (Tolomio, 2004a). I prelievi sono stati effettuati in zone di basso fondale, fuori dell’alveo dei canali navigabili e in condizioni di alta e di bassa marea, sia in fase di sizigia che di quadratura. In totale sono stati rinvenuti 104 taxa, prevalentemente costituiti da diatomee (86) e da cloroficee (14); mancano quasi del tutto le dinoficee. In primavera e in estate la microflora è apparsa ben diversificata (oltre 60 taxa) rispetto all’autunno e all’inverno, allorché il numero di taxa è risultato inferiore alla trentina; in ogni caso, anche quantitativamente si sono osservate differenze consistenti tra i vari periodi presi in esame. Ulteriori differenze si sono riscontrate in rapporto alla direzione della corrente, nonché all’ampiezza della marea.
D’altro canto, oltre che alla situazione idrodinamica contingente, le differenze nella tipologia e nell’abbondanza del plancton che si riscontrano in siti diver-si nel corso di un ciclo annuale sono imputabili e rapportabili alle peculiari condizioni bio-geochimiche che caratterizzano le aree esaminate, comprese le relazioni di interdipendenza trofica tra le varie comunità di organismi viventi in laguna. In questo contesto Bandelj et al. (2008) hanno evidenziato la do-minanza, tra le comunità autotrofe, delle diatomee, con particolare riguardo a Skeletonema costatum e a due specie che possono essere rimesse in sospen-sione dai fondali, Nitzschia frustulum e Cylindrotheca closterium, quest’ultima in grado di produrre rilevanti “fioriture” (fino a 66·106 cell./l.) come rilevato anche da Bianchi et al. (2000). Già in precedenza erano stati studiati i rapporti tra concentrazione dei nutrienti, quantità di materiale sospeso e abbondanza fitoplanctonica, sottolineando le differenze, più qualitative che quantitative, tra popolamenti di mare e di laguna, oltre alla tendenza pluriennale ad un aumento della densità numerica, soprattutto nel periodo estivo (Bianchi et al., 1998).
La composizione e la distribuzione del fitoplancton sono state oggetto di ricer-che svolte nell’area centrale della laguna con campionamenti mensili nel corso di due cicli annuali: novembre 1998-ottobre 1999 (quattro stazioni) e giugno 2000-maggio 2001 (tre stazioni) (Facca et al., 2002a; 2003; 2004 b). In una fase preliminare, limitatamente al mese di giugno del 1993 e del 1998, erano stati considerati altri 42 siti di prelievo al fine di operare un monitoraggio in seno a tutto il bacino relativamente ai parametri ambientali, al fitoplancton e alla biomassa delle macrofite, con successivo trattamento di tutti i dati median-te analisi statistica (Facca et al., 2004a). Nei campioni di fine primavera, nel 1993 si sono rinvenuti 51 taxa e nel 1998 54 taxa (di cui, rispettivamente, 29 diatomee, in prevalenza eupelagiche, e 40 diatomee, soprattutto ticopelagiche, in origine epipeliche, epilitiche o epifite), con presenza irrilevante di dinofi-cee (rispettivamente 11 e 7 entità). Le diatomee, alle quali si affiancano per importanza quantitativa nanoflagellati (cellule sferiche, con diametro inferio-re a 5 μm) e criptofice, sono costituite soprattutto da pennate, in particolare da Navicula lanceolata e Surirella ovata, mentre le centriche sono poco o nulla rappresentate. Nei campioni raccolti mensilmente durante i due cicli annuali, in cui non si sono considerate le dinoficee, il numero di diatomee aumenta in modo considerevole, peraltro anche con alcune proliferazioni massive da parte di Skeletonema costatum, Cylindrotheca closterium, Chaetoceros socialis, specie che insieme talora constituiscono più del 50% del numro totale di cellule.
Nell’arco di un anno (luglio 2001-giugno 2002) sono stati specificatamente stu-diati gli scambi di fitoplancton tra mare e laguna in corrispondenza delle tre bocche di porto, rapportando i risultati anche alla stagionalità dei popolamenti, con abbondanze elevate in estate e molto più ridotte in inverno (Bernardi Aub-ry & Acri, 2004). Le comunità fitoplanctoniche, che peraltro si differenziano in modo evidente in relazione alla direzione della corrente, sono risultate costitui-te per lo più da diatomee e soprattutto da nanoflagellati, mediamente con oltre il 50% del totale di cellule.
Osservazioni prolungate nel tempo consentono di meglio descrivere le variazioni quali-quantitative in seno alle comunità microalgali (Socal et al. 2006). L’esame di un decennio di dati (1998-2007) sulla variabilità temporale del fitoplancton in cinque stazioni del bacino settentrionale ha consentito di individuare, nel lungo periodo, una relazione tra il ciclo della biomassa microalgale e le fluttua-zioni stagionali di temperatura e irradiazione, di realizzare un “calendario del fitoplancton” sulla base delle variazioni tipologiche stagionali e di evidenziare, nella seconda metà del periodo esaminato, la tendenza ad una riduzione delle abbondanze, senza peraltro cambiamenti nella composizione delle comunità e alcuna correlazione con specifici fattori (Bernardi Aubry et al., 2013). Nel corso della ricerca è stata segnalata una presenza rilevante di nanoflagellati (in questo caso definiti come organismi indeterminati con dimensioni tra 3 e 4 μm, appartenenti a classi diverse) e, tra le diatomee, “blooms” in febbraio-marzo di Skeletonema marinoi, che, a seguito di un riordinamento della tassonomia delgenere sulla base di studi morfologici, ultrastrutturali e biochimici (Zingone et al., 2005;Sarno et al., 2005), sembra essere la specie prevalente, se non l’unica,presente in Alto Adriatico; tuttavia, al fine di non falsare i dati pregressi, nelle citazioni riportate nel presente lavoro si sono mantenuti i nomi indicati in ori-gine nelle varie pubblicazioni.
È opportuno qui ricordare che l’importanza dei nanoflagellati (sempre intesi come organismi sub-sferici, muniti di flagelli, con diametro inferiore a 5 μm) è stata più volte ribadita anche in zone di basso fondale e in siti confinati (valli da pesca) (Facca et al., 2009; 2013).
Le microalghe bentoniche
Periodo: dal 1980 in poi
Come premesso, in questa rassegna non può essere omessa un’altra frazione importante tra le microalghe lagunari, vale a dire quelle che vivono, temporane-amente o perennemente, fissate o striscianti, sul substrato, sia esso duro (natu-rale o artificiale) o mobile (sedimenti a diversa granulometria). Considerazioni a parte meriterebbero poi quelle forme che bene si adattano a vivere su altri organismi vegetali presenti nelle acque della laguna (macroalghe o faneroga-me), come già segnalato da Zanon (1938). Le microalghe bentoniche, per lo più costituite da diatomee e solo secondariamente da cianoficee e dinoficee, rive-stono infatti un ruolo non trascurabile nella produzione e accumulo di materia organica sul fondo e nella dieta di molti organismi animali (erbivori o limivori). In quest’ottica si sono affrontati studi sul periphyton (termine peraltro alquanto discusso: Iserentant, 1987) costituito dalle diatomee presenti in alcune valli da pesca (Val Dogà: Tolomio & Andreoli, 1989; Val Sparesera: Tolomio et al.,1991), utilizzando come substrato, per praticità metodologica e secondo isuggerimenti di molti autori, dei comuni vetrini porta-oggetto per microscopia (Castenholz, 1961; Sladeckova, 1962; Brown, 1976; Siver, 1977). Le specie rinvenute nelle due valli´ (rispettivamenteˇ´ 94 in Val Dogà e 64 in Val Sparese-ra) sono pressoché le stesse che vivono nelle acque della laguna viva; alcune manifestano una presenza costante e quantitativamente significativa (Cocconeis molesta, C. placentula, C. scutellum), altre, pur con discontinuità, possono esse-re talora molto abbondanti (e. g., Amphora exigua e Synedra tabulata). Queste attività di ricerca sulle diatomee bentoniche hanno costituito un primo approc-cio metodologico per la messa a punto di supporti idonei alla posa in situ dei vetrini impiegati in qualità di substrato da colonizzare (Tolomio & Moschin, 1995b). Nel corso di un intero anno solare, quindi in diverse condizioni meteo-climatiche, analizzando due stazioni caratterizzate da un diverso idrodinami-smo, sono state effettuate ulteriori prove sperimentali atte a testare criticamente le diverse tecniche di osservazione e ad individuare il periodo di tempo e il po-sizionamento più idonei per i substrati che devono essere colonizzati (Tolomio, 2004-2007a).
Dopo una fase preliminare di approccio metodologico (Tolomio et al., 2000 b), è stato affrontato anche lo studio di quelle microalghe che colonizzano i substrati mobili dei fondi lagunari. In un primo momento si sono considerati saggi raccolti con cadenza mensile in prossimità della superficie del sedimento (0 cm e – 1 cm) in più punti di un’unica stazione del bacino sud (Tolomio et al., 1999a). Si è osservato che le diatomee che si spostano tra gli interstizi traggono vantaggio dalla loro forma, in particolare dalle dimensioni: le cellule inferio-ri a 20-30 μm (nanofitobentos: Riaux & Germain, 1980) sono predominanti, mentre la presenza di quelle più grandi (e.g. Nitzschia longissima, N. sigma, Gyrosigma balticum, Pleurosigma normannii) e di alcune centriche provviste dimotilità nulla o molto limitata (i.e. Odontella aurita, Cyclotella meneghiniana, Melosira moniliformis, M. nummuloides e Thalassiosira weissflogii, quest’ultimamai prima segnalata in Adriatico) sembra essere circoscritta alla sola superficie del sedimento, a meno di un marcato rimescolamento idrodinamico del fonda-le, la cui granulometria peraltro varia in rapporto alla localizzazione dei siti di campionamento.
Proprio per questo in una fase successiva, sempre nel settore meridionale, si sono esaminate stagionalmente più stazioni tra loro differenziate per granulo-metria e distanza dal mare, prendendo in considerazione tre livelli: 0 cm, – 6 cm, – 12 cm (Tolomio et al., 2002a). Il tipo di sedimento può influenzare la colonizzazione da parte delle comunità di diatomee: la quantità di cellule e il numero di specie diminuisce verso il mare dove predominano le sabbie mentre verso l’interno i sedimenti argillosi e ricchi in materia organica appaiono più favorevoli allo sviluppo delle microalghe bentoniche, soprattutto nei livelli in-feriori. Navicula, Nitzschia, Amphora, Cocconeis e Achnanthes nell’ordine sono risultati i generi più significativi sia come numero di specie che come numero d’individui.
Nel bacino centrale, da novembre 1998 a ottobre 1999, oltre al fitoplancton, si è studiata anche la distribuzione temporale e spaziale delle diatomee che caratte-rizzavano i primi 3-4 mm dei sedimenti in quattro siti diversi per caratteristiche idrologiche (Facca et al., 2002 b). Sono state rinvenute 147 entità tassonomiche (molte d’incerta identificazione), con abbondanze alquanto variabili, comprese tra 0,7 x 106 e 10,4 x 106 cell.cm-3, rispettivamente in novembre in prossimità del mare e in agosto all’interno della laguna. A questo proposito viene menzionata come dominante Thalassiosira sp., forma inconsueta tra quelle che caratteriz-zano il microfitobentos. Peraltro, tenuto conto dell’influenza che l’idrodina-mismo esercita sui fenomeni di risospensione, rimescolamento e trasporto del particellato di fondo e, con esso, dei microrganismi che vi vivono, non si sono osservate significative differenze spazio-temporali tra le comunità prese in esa-me, ad eccezione del sito più influenzato dalle acque di scolo urbano e agricolo. In una fase successiva (da giugno 2000 a maggio 2001) l’andamento delle va-riazioni stagionali delle diatomee bentoniche è stato studiato limitando i cam-pionamenti, come per il fitoplancton, a tre stazioni (Facca et al., 2003). Non si è constatata una grande variabilità temporale, con valori più elevati comunque in primavera e all’inizio dell’estate; le abbondanze maggiori si sono registrate nei sedimenti a ridosso della terraferma: tra le forme prettamente bentoniche in evidenza soprattutto Cocconeis scutellum.
Gli stessi Autori hanno inoltre esaminato le variazioni quali-quantitative delle microalghe planctoniche e bentoniche in rapporto ai flussi di particellato in sospensione, che può essere limitante per lo sviluppo degli organismi autotrofi (Facca et al., 2002 c). Sono stati identificati 166 taxa, segnalando per ognuno l’habitat in cui è stato rinvenuto: una cinquantina di taxa sono esclusivi dei sedi-menti di fondo (tra i più abbondanti Diploneis crabro, Pleurosigma aestuarii, P. decorum). Se si considerano tutte le stazioni esaminate, una quindicina di entitàsono risultate comuni ai due habitat (per importanza meritano una menzione Amphora exigua, A. veneta, Cocconeis molesta, C. scutellum, Navicula ammophi-la, N. cryptocephala, N. lanceolata. Nitzschia amphibia, N. lanceolata, N. longis-sima, N. microcephala). Specie molto abbondanti nella colonna d’acqua, come Cylindrotheca closterium, pur essendo comuni ad entrambi gli habitat, mostra-no una presenza del tutto trascurabile sulla superficie del sedimento. Nelle ac-que libere, dove Skeletonema costatum ha talora rivelato proliferazioni massive, non mancano anche forme tipicamente bentoniche (e.g. Gyrosigma balticum, Pleurosigma distortum, Surirella ovata): ciò è ovviamente imputabile a fenomenidi risospensione dei sedimenti a seguito dell’idrodinamismo lagunare, i cui ef-fetti per motivi diversi si fanno sentire sia sui bassifondi che in corrispondenza dei canali (Facca & Sfriso, 2011).
Studi sulla distribuzione spaziale e temporale (da giugno 2000 a giugno 2002) delle diatomee epipeliche in rapporto ai parametri ambientali sono stati effet-tuati in sei stazioni variamente distribuite e differenziate tra loro nell’area cen-trale del bacino lagunare, operando una puntuale analisi statistica sui risultati, in particolare su quelli di abbondanza, e stilando una lista di 157 taxa rinvenuti nei sedimenti delle stazioni esaminate (Facca & Sfriso, 2007). In giugno-lu-glio 2003 l’indagine è stata estesa ad altri 165 siti distribuiti in tutto il bacino. Nell’arco temporale i valori di abbondanza hanno mostrato variazioni rilevanti e differenziate da stazione a stazione, con picchi talora superiori anche a 3 x 106 cell./ml. I generi più rappresentativi sono risultati Amphora, Gyrosigma, Navi-cula, Nitzschia e Pleurosigma, con alcune entità che hanno un’ampia diffusionespaziale. Ma anche altre specie (i.e. Cocconeis molesta, C. scutellum, Grammatophora oceanica, Gyrosigma acuminatum, Psammodyction panduriforme e Thalas-sionema nitzschioides) erano presenti in tutti i siti di raccolta.
Per ampliare le conoscenze sulla microflora dei substrati mobili è stata svolta anche una indagine atta a verificare l’influenza della luce e della temperatura sulle diatomee bentoniche, mettendo a punto una tecnica per trasferire in labo-ratorio piccole porzioni di fondale lagunare da sottoporre a prove sperimentali programmate (Tolomio, 2004b). I risultati di queste ricerche nel loro insieme hanno evidenziato innanzitutto il ruolo che riveste il tipo di sedimento sulle possibilità di colonizzazione da parte delle diatomee, in secondo luogo l’azione determinante del fattore luce sullo sviluppo di queste microalghe. Si tratta in-fatti di organismi in grado non solo di attecchire e popolare lo strato a diretto contatto con le acque libere, ma di migrare anche tra gli spazi interstiziali fino a diversi centimetri di profondità, palesando peculiari strategie a livello fisio-metabolico, con un cambiamento del sistema di nutrizione (da autotrofo ad eterotrofo). Oltre alle diatomee pennate (un centinaio di entità), di cui si co-noscono le capacità migratorie (Bertrand, 1992), si sono rinvenute anche una quindicina di diatomee centriche, la cui presenza è conseguenza di particolari adattamenti alla vita sessile.
Poiché esistono indubbi rapporti tra le diatomee “libere”, vale a dire quelle che vivono in sospensione, e le diatomee che a vario titolo mostrano rapporti con il substrato, sia esso duro che mobile, si sono effettuati campionamenti contemporanei di entrambe queste componenti, sia in una stazione nel bacino meridionale, con rinvenimento in totale di 113 diatomee (Tolomio, 2004-2007 b), sia in una stazione nel bacino settentrionale, in cui sono state identificate complessivamente 102 Diatomee (Tolomio, 2004-2007c). I risultati hanno di-mostrato come non risulti una evidente e stretta interdipendenza tra diatomee planctoniche e diatomee bentoniche, probabilmente a causa dell’accentuata va-riabilità ambientale che condiziona in maniera diversa la tipologia e la quantità degli organismi presenti nei due habitat.
Una ricerca analoga è stata condotta nel corso di un anno (marzo 2008-febbraio 2009) in due stazioni tra il centro storico di Venezia e Porto Marghera, tra loro differenti per ricambio mareale e idrodinamismo (Facca & Sfriso, 2011). Il confronto tra le comunità microalgali caratterizzanti i due ambienti ha eviden-ziato, per le diatomee bentoniche, differenze statisticamente significative per quanto concerne sia le abbondanze che le fluttuazioni stagionali; invece, nel caso del fitoplancton che comprende però l’insieme di tutte le forme microal-gali, alcune molto numerose (e.g. criptoficee, nanoflagellate, queste con più del 50% del totale, ed euglenoficee, in particolare Eutreptiella marina), si è registra-ta una sostanziale concordanza nei valori di abbondanza nonché nelle fluttua-zioni stagionali, eccezion fatta per quanto osservato in maggio nella stazione del canale in cui le nanoflagellate hanno portato la densità cellulare a più di 22 x 106 cell./L. Da evidenziare tra le diatomee, sia nelle acque libere che nei sedimenti, una specie attribuibile al genere Thalassiosira, che “nell’habitat bentonico ha rappresentato una componente costante e spesso dominante”, in analogia con quanto osservato in precedenza dagli stessi Autori (Facca & Sfriso, 2007).
In lavori recenti, utilizzando materiali e dati raccolti in precedenza, si è voluto evidenziare il ruolo che i diversi tipi di substrato duro rivestono sui fenomeni di colonizzazione da parte delle microalghe bentoniche. Allo scopo si sono ef-fettuate sperimentazioni in vasche chiuse, alimentate solo con acque di marea entrante, impiegando come substrato alcuni dei materiali normalmente usati nella costruzione di manufatti lungo i canali e nei centri abitati (Tolomio, 2016 a). L’evoluzione annuale dei popolamenti, con massimo sviluppo tra aprile e settembre e stasi vegetativa autunno-invernale, è determinata da un numero ristretto di entità, tra cui è opportuno ricordare Amphora hyalina, Halamphora exigua, Cocconeis molesta ed Entomoneis paludosa. Nel gioco della colonizzazione, alle diatomee talora si affiancano le cianoficee, in particolare con specie appartenenti ai generi Lyngbya e Spirulina, che possono svolgere un’azione an-tagonista nei confronti di altre specie, diatomee in primo luogo, alterandone i valori di presenza. Come prevedibile, i materiali più favorevoli si sono rivelati quelli a superficie scabra. I dati relativi a campioni di plancton raccolti men-silmente nella vasca sono poco rapportabili a quelli ottenuti per il microfito-bentos, a causa della presenza percentualmente elevata di altri organismi come dinoficee e microflagellate.
Tenuto conto dell’influenza dell’idrodinamismo sulle possibilità di attecchi-mento al substrato da parte delle diatomee, una ricerca analoga è stata effet-tuata in un’area lagunare aperta (Canale S. Nicolò), sottoposta a correnti e moto ondoso e pertanto presumibilmente meno favorevole alla colonizzazione (Tolomio, 2016b). In questo sito risultano quantitativamente prevalenti Cera-toneis closterium, Cocconeis scutellum, Grammatophora oceanica, Licmophora flabellata, Navicula grevillei, Striatella unipunctata, Tabularia fascicolata, e, casoinconsueto, Melosira moniliformis. Non trascurabile anche in questa stazione il ruolo delle cianoficee, in particolare di Spirulina subsalsa. La componente fito-planctonica varia molto in rapporto alla direzione della corrente di marea: for-me prettamente eupelagiche in quella entrante (Chaetoceros spp. e Rhizosolenia spp.), forme per lo più ticopelagiche in quella uscente, come evidenziato ancheda Bernardi Aubry & Acri (2004), in buona parte comuni con quelle rinvenute sui substrati immersi.
A prescindere dal ruolo che la dinamica mareale assume nel controllo della variabilità idrologica, sovrapponendosi ad altri fattori climatici dovuti alla sta-gionalità (Acri et al., 1995), non si possono peraltro tralasciare le relazioni tra microalghe e macroalghe che vivono nelle acque lagunari, tenuto conto sia del-la reciproca competizione per l’assimilazione dei nutrienti, sia dei rapporti tra organismi epifitici e supporto ospite. Su questa base si sono sviluppati studi specifici (Sfriso et al., 1989; Sfriso & Pavoni, 1994) che, pur non considerando direttamente i popolamenti fitoplanctonici, bensì i prodotti della loro attività fisiologica, completano il quadro delle relazioni esistenti tra organismi di diver-so livello evolutivo e ambiente.
Di recente, attraverso il monitoraggio temporale e spaziale delle comunità fito-planctoniche in rapporto ai fattori biotici, si è cercato di stabilire, anche per que-sti ambienti come già avviene per quelli d’acqua dolce (Kelly, 1998, Dell’Uo-mo, 2004), un indicatore delle qualità delle acque, basato soprattutto sui dati inerenti la composizione, l’abbondanza e la biomassa delle comunità stesse, pre-senti non solo a Venezia ma anche in altri bacini lungo le coste italiane (Facca & Sfriso, 2009). Con queste premesse si è successivamente arrivati alla descrizione di un indice (MPI) idoneo a definire una stima qualitativa delle acque in aree di transizione come le lagune (Facca et al., 2014b).
La rassegna resta aperta: le comunità microalgali, sia planctoniche che bentoni-che, evolvono, si avvicendano e mutano nella loro struttura in rapporto ai cam-biamenti dell’ambiente in cui si sviluppano; questo induce ad una comparazione tra le ricerche recenti e quelle svolte in tempi passati, pur tenendo conto dei pro-gressi tecnico-metodologici e degli aggiornamenti sistematici (Acri et al., 2004).
Metodologie
Campionamento, conservazione e studio del materiale
Per quanto concerne i lavori più recenti le metodiche vengono citate e talora de-scritte di volta in volta, il che spesso non vale per i lavori meno recenti. Riguar-do i metodi di allestimento e analisi dei preparati ai fini della stima del numero di cellule mediante conteggio, oltre che dalle pubblicazioni di Utermöhl (1931, 1958), è possibile trarre indicazioni anche da Lund (1951), Lund et al. (1958) e da Willem (1976). Un’ampia sintesi sulle tecniche di raccolta, di preparazione e di studio del fitoplancton è riportata in un voluminoso manuale edito a cura di Sournia (1978) con il patrocinio dell’UNESCO; altre utili informazioni si possono trovare in Lenzi Grillini et al. (1978), in Jacques (1979) e in Zingo-ne et al. (1990); più recente è un manuale pubblicato sotto l’egida dell’ISPRA (Socal et al., 2010), manuale che rappresenta un esaustivo aggiornamento delle precedenti pubblicazioni al riguardo.
Ordinamento tassonomico e referenze bibliografiche
Le moderne tecniche di studio hanno determinato, a torto o a ragione, un’e-voluzione piuttosto rapida e talora radicale dei criteri su cui si basa l’inqua-dramento tassonomico. Ciò è imputabile soprattutto all’impiego sempre più diffuso della microscopia elettronica a scansione e, secondariamente, anche a trasmissione, con individuazione di caratteri distintivi a livello ultrastrutturale che consentono classificazioni più precise e dettagliate. La lista floristica ri-portata nel presente lavoro rappresenta quindi un inevitabile compromesso tra quanto segnalato dai vari autori nel corso degli anni e quanto è oggi possibile reperire nelle più recenti pubblicazioni al riguardo.
Per agevolare il reperimento e la consultazione delle principali fonti biblio-grafiche a carattere tassonomico, vengono di seguito segnalate le opere di maggiore impiego nello studio delle classi più importanti e cioè: per le Cya-nophyceae, Geitler (1932) e Prescott (1962); per le Dictyochophyceae, Ge-meinhardt (1930); per le Dinophyceae, Lebour (1925), Böhm (1931), Schil-ler (1933-37), Balech (1974, 1976), Dodge (1975, 1982), Sournia (1967a, 1967b, 1978), Rampi & Bernhard (1980); per le Bacillariophyceae, Kützing (1865), Van Heurck (1890-91, 1899), Peragallo H. (1890-91), Peragallo H. & H.M. (1897-1908), Hustedt (1930-66), Hendey (1964), Van der Werff & Huls (1957-74), Rampi & Bernhard (1978), Navarro (1981a, 1981b, 1982a, 1982b, 1982c, 1983a, 1983b); per le Chlorophyceae, Lemmerman et al. (1915) e Prescott (1962); per le Euglenophyceae, Huber-Pestalozzi (1955); per le Coccolithophyceae, Schiller (1930), Okada & McIntyre (1977) e Rampi & Bernhard (1981).
Nella terminologia si sono seguiti i suggerimenti di Van Landingham (1967-79), Sournia (1986), Ricard (1987), Krammer & Lange-Bertalot (1986, 1988, 1991a, 1991b), Chrétiennot-Dinet (1990), Round et al. (1990), Ludes & Co-ste (1996), Tomas (1997). Al manuale edito da quest’ultimo autore, per com-petenza specifica, hanno contribuito R. Hasle & E.E. Syvertsen (Diatomee), K.A. Steidinger & K. Tangen (Dinoflagellate), J. Throndsen (Flagellate), B.R. Heimdal (Coccolitoforidee).
I taxa sono stati raggruppati per classi. Con i limiti imposti dalla continua re-visione dei nomi di generi e specie alla luce di tecniche introspettive le più moderne, si è operato un controllo nomenclaturale di tutti i taxa, fornendo a margine dell’elenco, nel caso di aggiornamenti, la sinonimia correntemente accettata secondo quanto riportato sul sito internet www.algaebase.org. (Guiry M.D. & Guiry G.M., 2017)
Considerazioni a parte, anche per il ruolo molto significativo che può assume-re nelle acque della laguna, merita un insieme di organismi, definiti con una terminologia non sempre omogenea da parte degli studiosi (flagellati nudi, microflagellati, nanoflagellati, non-Utermöhl-fitoplancton) e caratterizzati da una collocazione tassonomica alquanto ampia (Chlorophyceae, Chlorodendro-phyceae, Chrysophyceae, Cryptophyceae). Si tratta in verità di un gruppo atipi-co costituito da cellule di piccole dimensioni, sprovviste di teca rigida e munite di flagelli o ciglia. Travers (1973) ha fornito alcuni criteri distintivi come le dimensioni, comprese tra 1,5 e 12 μm (più frequentemente tra 2 e 6 μm). Già in precedenza Lohmann (1911) aveva introdotto il termine nanoplancton per indicare organismi con cellule comprese tra 1 e 25 μm, ma solo successivamente (Sieburth et al., 1988) si è avuta una codificazione in gruppi meglio identificati dal punto di vista dimensionale: picoplancton (0,2-2 μm), nanoplancton (2-20 μm), microplancton (20-200 μm), come riproposto anche da Throndsen (1997) con lievi modifiche.
Allestimento dell’atlante fotografico
Microscopia ottica (M.O.)
Le fotografie al microscopio ottico sono state realizzate utilizzando apparati fotografici automatici o semiautomatici (Leitz: Orthomat, WPS 51), montati su microscopi da ricerca (Leitz: Ortholux, Dialux) o su microscopi invertiti (Leitz: Diavert, Labovert, Fluovert), questi ultimi provvisti di apparato a contrasto di fase. Nel primo caso si sono allestiti dei preparati provvisori senza aggiunta di collanti, in qualche occasione trattando il materiale, ai fini di una migliore os-servazione, secondo i suggerimenti di Zingone et al. (1990); nel secondo caso si sono impiegate delle vaschette con cilindro di sedimentazione separabile, al fine di poter sfruttare al meglio il contrasto di fase (metodo di Utermöhl, 1958, ridescritto da Sournia, 1978).
Microscopia elettronica a scansione (M.E.S.)
Molto del materiale raccolto è stato studiato anche al microscopio elettronico a scansione che rappresenta, nei lavori effettuati in tempi relativamente recenti, un mezzo d’indiscussa utilità nella soluzione di problemi legati alla moderna tassonomia. I preparati sono stati allestiti secondo la metodica tradizionale: di-sidratazione con soluzioni progressivamente più concentrate di etanolo, cen-trifugando di volta in volta a 1500 giri/min. per 15 minuti; trattamento con la tecnica del punto critico (C.P.D.); incollaggio su supporto metallico utilizzando un nastro biadesivo al carbone; metallizzazione con oro (sistema sputtering). Le fotografie sono state eseguite tra 8 e 12 kV, utilizzando un microscopio Philips PSEM 500 o un microscopio Cambridge Stereoscan 260.
Commento sulle classi microalgali presenti in laguna
Cyanophyceae (17 taxa)
Le Cianoficee, che alcuni ritengono avere la citologia dei batteri e la fisiologia delle alghe (Sournia, 1986) e che sono notoriamente dulcicole, costituiscono un gruppo relativamente poco rappresentato nelle acque della laguna, almeno per quanto concerne le forme planctoniche; molto più significativa è invece la loro presenza sui substrati mobili e, soprattutto, su quelli duri, dove formano la frazione primaria, in ordine di tempo, degli organismi colonizzatori (“foulers”). Tra le cianoficee planctoniche molte cellule di tipo coccoide, di piccola taglia (da 1 a 5 μm), per lo più appartenenti all’ordine Chroococcales, vengono rite-nute, assieme ad altre forme parimenti minuscole, componenti significative del cosiddetto “nanoplancton”.
Tra le cianoficee bentoniche merita una citazione particolare Spirulina subsalsa (Tav. 1, fig. a), che spesso, sui substrati solidi, costituisce delle pellicole fitte e continue, ricche talvolta di filamenti mucillaginosi, tanto da ostacolare, in una sorta di competizione interspecifica, l’adesione di altri microrganismi, come, ad esempio, le diatomee.
Dictyochophyceae (5 taxa)
Si tratta di forme planctoniche, esclusivamente marine, che in Adriatico mani-festano una presenza più abbondante durante le stagioni fredde e che talvolta vengono segnalate anche nelle lagune, compresa quella di Venezia, senza assu-mere mai una diffusione degna di nota (Tolomio, 1976b).
Presentano uno scheletro siliceo, costituito da tubuli cavi e apparentemente interno a causa della formazione di espansioni citoplasmatiche. L’inquadramento sistematico di questa classe è tutt’altro che risolto: per alcu-ni (Sournia, 1986) comprende un unico genere (Dictyocha Ehrenberg) che in-globa per sinonimia diversi generi istituiti in precedenza (Cannopilus Haeckel, Distephanus Stöhr, Octactis Schiller, Mesocena Ehrenberg), per altri (Tomas,1997) si fraziona in più ordini, tra cui quello delle Dictyochales, che include tre generi: Dictyocha, Octactis e Mesocena. Attualmente l’ordine comprende 12 generi (Guiry & Guiry, 2017).
In effetti le forme rinvenute a Venezia (Tav. 1, figg. b-g), pur suscitando qual-che perplessità strutturale, sembrano tutte riconducibili al genere Dictyocha, accettando la semplificazione proposta da Sournia (1986), eccezion fatta per Mesocena octactis, e ritenendo le varie entità espressione di una variabilità intra-specifica (ecomorfosi).
Ebriophyceae (1 taxon)
Queste forme vengono da alcuni (Sournia, 1986) ascritte come ordine (Ebria-les) alla classe delle Dinophyceae, da altri (Silva, 1980) in qualità di classe al phylum Protozoa incertae sedis. Invero si tratta di organismi esclusivamente marini, in Adriatico presenti con una sola specie (Ebria tripartita); peraltro mo-strano una struttura peculiare e caratteristica, ben differente rispetto a quella delle dinoficee propriamente dette.
Dinophyceae (193 taxa)
Questa classe, nelle acque veneziane, è costituita da entità prettamente meso-eualobie, che si possono rinvenire anche nelle parti più interne del bacino lagu-nare, ivi trasportate passivamente dalle acque di marea entrante e soggette co-munque ad una conseguente regressione quantitativa. Preferenzialmente sono termofile e quindi diffuse soprattutto nel periodo estivo-autunnale.
Sia la struttura esterna che quella interna sono complesse e diverse da genere a genere. Alcune forme sono sprovviste di pigmenti clorofilliani, il che, unita-mente ad altri caratteri come eterotrofia e motilità (quest’ultima legata alla pre-senza di due distinti flagelli), le accomuna ai protozoi. A prescindere da queste considerazioni che porterebbero comunque a inconcludenti discussioni, vale la pena di soffermare l’attenzione su alcuni aspetti tipici di questi organismi. Le dinoficee sono caratterizzate da una teca o amphiesma (dal greco άμφίεσμα = rivestimento), costituito da una membrana esterna e da uno strato vescico-lare interno che nella maggior parte dei casi (vale a dire, nelle forme tecate o “corazzate”: Dodge, 1982) si trasforma in una struttura a placche cellulosiche, lievemente sovrapposte in corrispondenza dei margini (suture), sulla forma e sul numero delle quali (tabulazione) si fondano i criteri distintivi e conseguen-temente la loro tassonomia.
In effetti, proprio la tabulazione ha indotto negli ultimi decenni a rivedere la nomenclatura e la composizione di alcuni generi, primo tra tutti, anche per im-portanza, Protoperidinium Bergh (Tavv. 7-9; Tav. 10, figg. a-b), cui sono state as-segnate tutte quelle forme (circa 330 di cui una quarantina segnalate nelle acque veneziane) che presentano 5 o 6 placche cingolari, mentre il genere Peridinium Ehrenberg comprende solo quelle con 4 placche cingolari (Balech, 1974), per la maggior parte dulcicole (solo 6 rinvenute in laguna).
Analoghe considerazioni si possono fare anche nel caso del genere Dinophysis Ehrenberg (Tav. 4, figg. a-m) che ha inglobato specie prima attribuite al genere Phalacroma Stein (Tav. 10, figg. c-k), il quale in effetti si distingueva solo per undifferente sviluppo dell’epiteca (Balech, 1976).
Anche nel caso dei generi Exuviaella Cienkowski (Tav. 4, fig. n-p) e Prorocen-trum Ehrenberg (Tav. 11, figg. d-l; Tav. 12, figg. a-b) si sono avute controversie di tipo tassonomico, basate essenzialmente sulla funzione dei pori (flagellare e ausiliario), sulla presenza di un dente apicale più o meno sviluppato e sulla individuazione del lato dorsale e del lato ventrale e contestualmente della valva destra e di quella sinistra. Gli studi di Abé (1967) e di Dodge (1965, 1975) han-no portato all’abolizione della distinzione tra i due generi, con mantenimento del solo genere Prorocentrum. Delle circa 80 specie attualmente accettate tasso-nomicamente, una ventina sono state rinvenute nelle stazioni in laguna.
Altro genere sottoposto di recente ad una radicale revisione (Gómez, 2013) è Ceratium Schrank, (Tav. 2; Tav. 3, figg. a-h), con reintroduzione del genere Tri-pos Bory, che in totale comprende circa 150 entità tassonomiche correntementeaccettate (circa 20 quelle rinvenute in laguna).
Per altri generi (i.e. Goniodoma Stein [Tav. 5, figg. c-m], Gonyaulax Diesing [Tav. 6, figg. a-h], Gymnodinium Stein, Oxytoxum Stein) variazioni e aggiorna-menti nomenclaturali sono meno frequenti, limitati a qualche specie dalle ca-ratteristiche già in origine poco definite. Solo nel caso del genere Glenodinium Ehrenberg (Tav. 5, figg. a-b), un discreto numero di entità è stata trasferito al genere Peridiniopsis Lemmermann, relativamente a forme però che sono per lo più dulcicole (Bourelly, 1970).
In ogni caso si tratta di organismi che sono prevalentemente planctonici, in qualche caso anche dotati di soddisfacenti strutture per il galleggiamento. D’al-tro canto alcune specie sono dotate di tricocisti che, oltre a difesa e osmorego-lazione, rivestono la funzione di attacco al substrato.
Di alcune entità per lo più appartenenti ai generi Gonyaulax e Protoperidinium (Sournia, 1986) sono state individuate delle cisti di resistenza (ipnozigoti) che, in caso di condizioni ambientali avverse, sedimentano e possono mantenersi sul fondo anche per lungo tempo prima di germinare (Dale, 1983).
Va ricordato infine che nell’ambito di questa classe esistono specie potenzial-mente tossiche, alcune delle quali, in qualche occasione, sono state segnalate nell’invaso lagunare, ma mai in quantità particolarmente abbondanti; di con-seguenza, al riguardo non si sono mai avute segnalazioni di “biointossicazioni” (Tolomio & Moschin, 1995a).
Bacillariophyceae (795 +1 taxa)
Le Bacillariophyceae rappresentano il gruppo dominante tra le alghe unicellula-ri; possono essere planctoniche o bentoniche o ticopelagiche, isolate o coloniali e popolano gli ambienti più diversi. La loro classificazione si basa soprattutto sulla forma e sulla simmetria della teca esterna silicea (frustulo): negli ultimi de-cenni si sono avuti notevoli rimaneggiamenti e aggiornamenti nomenclaturali, con istituzione spesso di generi nuovi (Round et al., 1990) o spostamento di una specie da un genere ad un altro.
In questo contesto si è preferito mantenere la sola classe delle Bacillariophyceae anziché adottare una recente suddivisione che prevede più classi (i.e. Coscino-discophyceae, Mediophyceae, Bacillariophyceae, Fragilariophyceae, quest’ulti-ma non da tutti accettata) (Cox, 2015), derivanti dalla suddivisione del phylum Bacillariophyta; tutto ciò al fine di non generare difficoltà nella lettura dei dati acquisiti in passato. Inoltre si è qui tralasciata la precedente suddivisione im-postata sul principio della simmetria (con i due ordini Centrales e Pennales) in quanto non più consona ai moderni criteri di classificazione basati non tanto sulla simmetria (raggiata o bilaterale) quanto su giustificazioni di tipo ultrastrut-turale e fisiologico (Silva, 1980; Round et al., 1990; Medlin & Kaczmarska, 2004).
In laguna, tra i generi maggiormente rappresentati come numero di specie, non tenendo conto delle più recenti variazioni tassonomiche, sono da annovera-re Amphora Ehrenberg ex Kützing (57 entità) (Tav. 14, figg. a-k), Chaetoceros Ehrenberg (58 entità) (Tav. 16, figg. b-k), Navicula Bory (92 entità) (Tavv. 23 e 24) e Nitzschia Hassall (87 entità) (Tav. 25). Peraltro, nel caso di Amphora e di Nitzschia, diverse entità (17 per la prima e 21 per la seconda) sono confluite indue generi, Halamphora (Cleve) Levkov comb. nov. e Tryblionella W. Smith, se-condo le indicazioni rispettivamente di Levkov (2009) e di Round et al. (1990). Ma non meno significativi risultano anche generi come Diploneis (24 entità) (Tav. 19, figg. g-k), Gyrosigma Hassall (19 entità) (Tav. 20, figg. b-i), Licmopho-ra C. Agardh (17 entità) (Tav. 21), Mastogloia Twaites ex W. Smith (15 entità)e Pleurosigma W. Smith (27 entità) (Tav. 26, figg. c-i), che peraltro includono molte forme ticopelagiche. Di questa componente si deve assolutamente tener conto in un ambiente in cui idrodinamismo e scarsa profondità possono favo-rire il distacco e la risospensione di esemplari in origine adesi al substrato, sia duro che mobile. Anche il genere Cocconeis Ehrenberg (23 entità) (Tav. 17), co-stituito da forme decisamente bentoniche, non si sottrae a tali processi di dina-mica ambientale, pur presentando dei sistemi di ancoraggio piuttosto efficienti. Alcuni generi (e.g. Coscinodiscus Ehrenberg [Tav. 18, figg. a-k), Rhizosolenia Ehrenberg [Tav. 26, figg. j-o]), oltre al già citato Chaetoceros), si ritrovano quasi esclusivamente nelle acque libere, a conferma del loro adattamento ad una vita prettamente pelagica.
La classe è completata poi da un gran numero di altri generi, meno rappresen-tativi come numero di specie (in qualche caso anche una sola) ma talvolta non meno importanti come presenza d’individui. Si possono citare al riguardo le specie Cerataulina pelagica (Tav. 16, fig. a), Cylindrotheca closterium (Tav. 19, fig. a), Leptocylindrus danicus, N. seriata (Tav. 25, fig. j), Skeletonema costatum sensu lato (Tav. 27, figg. b-d), Striatella unipunctata (Tav. 27, figg. e-g), Thalas-sionema nitzschioides; in particolare, Nitzschia seriata e Skeletonema costatum sensu lato sono responsabili in più occasioni di vere e proprie proliferazionimassive.
Un discorso a parte merita Phaeodactylum tricornutum, che presenta una posi-zione sistematica ancora discussa (Round et al., 1990) tanto da essere collocato allo stato attuale tra le Bacillariophyta incertae sedis (Guiry & Guiry, 2017).
Chlorophyceae (63 taxa)
Anche se si tratta di una classe costituita da forme essenzialmente dulcicole e pertanto forse poco considerata nei campioni di laguna, tuttavia la loro presen-za è tutt’altro che infrequente, soprattutto nella zone perimetrali finanche in quelle di “laguna viva”, in concomitanza con le fasi di deflusso.
Pochi i generi con forme che vivono in acque marine o salmastre o quanto meno che vi si adattano: Dunaliella Teodoresco, Chlamidomonas Ehrenberg, Carteria Diesing, la prima con cellule avvolte da una membrana fine ed elastica, le altre con parete rigida. Il resto dei taxa rinvenuti sono ascrivibili al plancton conti-nentale, in seno al quale, nei campioni di laguna, rivestono un ruolo prevalente il genere Pediastrum Meyen (in particolare P. duplex: Tav. 1, fig. h) e il genere Scenedesmus Meyen, quest’ultimo con 18 specie, di cui circa la metà viene oggiripartita in due generi: Tetradesmus G.M. Smith, ripristinato di recente (Wynne & Hallan, 2016) e Desmodesmus (Chodat) An, Friedl & Hegewald, ridescritto da An et al. (1999). Gli altri generi sono tutti meno rappresentati e si rinvengo-no in maniera decisamente occasionale.
Chlorodendrophyceae (3 taxa), Xanthophyceae (2 taxa), Chrysophyceae (2 taxa), Cryptophyceae (3 taxa), Katablepharidophyceae (1 taxon)
Si tratta di classi rappresentate da pochissime specie, marine, salmastre o d’ac-qua dolce, rinvenute sporadicamente e sempre con scarso numero d’individui, quindi poco significative in seno alla microflora lagunare. Peraltro, in conside-razione delle dimensioni minute, la loro determinazione risulta sempre alquan-to problematica.
Euglenophyceae (32 taxa)
Quattro generi rappresentano la quasi totalità dei taxa appartenenti a questa classe: Estasia Dujardin, Eutreptia Perty, Eutreptiella da Cunha, Euglena Eh-renberg, quest’ultima maggiormente rappresentata come numero di specie ma non come numero d’individui in considerazione delle sue caratteristiche dul-cicole. Forme invece ritenute marine, come Eutreptia lanowii ed Eurtreptiella marina, possono talvolta mostrare presenze assai ragguardevoli.
Coccolithophyceae (35 taxa)
Per questa classe, istituita da Rothmaler nel 1951 e in seguito variamente rima-neggiata, si è adottato l’inquadramento sistematico proposto e rivisto da Silva et al. (2007) nell’ambito del phylum Haptophyta (Cavalier-Smith, 1986), in cuile Coccolithophyceae sono collocate.
Si tratta di organismi generalmente ricoperti da scaglie calcificate di forma assai variabile (coccoliti, da cui il nome della classe), planctonici nella acque marine e in quelle salmastre, dove però si ritrovano più di sovente nelle aree a salinità medio-alta.
Nei campioni di laguna i generi più rappresentativi risultano Syracosphaera Lohmann, Rhabdosphaera Haeckel e Calyptrosphaera Lohmann, mai comun-que con abbondanza o diffusione degne di nota. Solo Emiliania huxleyi, specie ubiquista e per questo euriecia, viene più volte segnalata nelle acque veneziane, talora anche in quantità rilevanti.
Haptophyta incertae sedis (1 taxon)
Si tratta di una definizione tassonomica controversa e discutibile sia in quali-tà di phylum (Cavalier-Smith, 1986), sia come classe e come ordine, secondo quanto proposto di recente da Guiry & Guiry (2017). In precedenza queste forme venivano incluse tra le Prymnesiophyceae (ord. Coccolithophorales) (Chrétiennot-Dinet, 1990).
Tab. 1. (IN DOWNLOAD) Elenco dei taxa rinvenuti nella Laguna di Venezia (incluse le valli da pesca e i porto-canali) a partire dal 1912 fino ai giorni nostri. Nella colonna di sinistra è riportata la nomenclatura con cui i vari taxa sono stati segnalati; nelle colonne al centro sono indicati gli Autori delle segnalazioni sulla base del seguente abbinamento: L = Lavori anteriori al 1945 (Carazzi & Grandori, Teodoro, Migliardi O’Riordan, Issel, Zanon); M = Marchesoni; V = Voltolina; A = Andreoli o Andreoli et al.; S = Socal o Socal et al., Sfriso o Sfriso et al.,Facca et al.,BernardiAubry et al.; T = Tolomio o Tolomio et al.; nella colonna di destra la nomenclatura, se diversa da quella originaria, è stata aggiornata con le sinonimie attualmente accettate. I taxa ontrassegnati con il simbolo ● sono presenti nell’atlante fotografico; il numero a fianco indica la tavola relativa.
Tavv. 1-28. Le foto sono state tutte eseguite al microscopio elettronico a scansione salvo diversa indicazione: M.O. = microscopio ottico su vetrino porta-oggetti; M.O.c.f. = microscopio ottico con contrasto di fase in vaschette di sedimentazione. Le varie specie sono citate con il nome riportato in tab. 1; il nome accettato correntemente, se diverso, viene segnalato tra parentesi.
Osservazioni conclusive
Lo scopo di questo lavoro, oltre a quello di presentare un compendio di quanto prodotto in passato al riguardo, è stato quello di far comprendere le varie pro-blematiche che concernono organismi tanto importanti, se pur poco visibili ad occhio nudo, nell’ambito dei processi biologici dell’intero ecosistema.
L’eterogeneità dell’ambiente rende ragione del grande numero di taxa segnalati in questa rassegna (1154), oltre che della loro varietà tipologica. Specie eualobie e oligoalobie, pelagiche e neritiche, coloniali o isolate, ticopelagiche o pretta-mente bentoniche, fisse o mobili, ecc., si trovano a convivere in un mezzo in continua e ritmica evoluzione.
Conformemente alla disomogeneità degli organismi da esaminare e ai loro di-versi habitat, si sono dovute approntare nuove tecniche di campionamento e metodologie di studio sempre più conformi ai recenti mezzi d’indagine.
In ogni caso, ogni singola ricerca, se pur finalizzata ad una specifica problemati-ca, rappresenta un importante e ulteriore contributo alla conoscenza dell’intero sistema lagunare, in considerazione del ruolo primario che le microalghe rive-stono nella scala biologica.
I risultati ottenuti nelle varie ricerche, se analizzati e paragonati tra loro, con-sentono sicuramente di meglio comprendere le caratteristiche della laguna nella sua globalità, se pur soggetta nel tempo ad un impatto antropico sempre più evidente e spesso deleterio. Proliferazioni massive di certe specie, presenza di entità alloctone mai prima segnalate o tipiche di zone geografiche lontane (Tav. 3, figg. k-m), comparsa di individui morfologicamente diversi dall’olotipo (Tav. 4, fig. i; Tav. 17, figg. k-l), segnalazione di specie nuove (Tav. 12, figg. a-b), insor-genza di anomalie a livello cellulare, ritrovamento di forme con caratteri difficil-mente riscontrabili nelle specie conosciute (Tav. 1, figg. i-j), ecc., rappresentano un segnale nei confronti di quanto succede nell’ambiente, spesso soggetto a cambiamenti forzosamente indotti ed estranei ad una evoluzione prettamente naturale. Un valido aiuto per la sua tutela potrebbe essere l’individuazione di indicatori biologici basati, nel caso specifico, sulla struttura delle comunità fi-toplanctoniche e sulle relazioni tra abbondanza e biomassa come già proposto attraverso l’uso delle macrofite (Sfriso et. al., 2007; 2009).
Ringraziamenti
Dedico questo lavoro alla memoria di mia moglie Mariuccia, che tante volte mi ha sostenuto nel corso della mia attività di ricerca.
Desidero esprimere viva riconoscenza a quanti (tecnici, laureandi e studenti) hanno contribuito alla raccolta e allo studio dei campioni nell’ambito dell’atti-vità didattica e scientifica svolta presso il Dipartimento di Biologia dell’Univer-sità degli Studi di Padova.
Un ringraziamento particolare al sig. Renzo Mazzaro per la preziosa collaborazio-ne e la sempre cortese disponibilità nella realizzazione delle tavole fotografiche. Un debito di gratitudine infine ai due revisori anonimi che hanno contribuito, con i loro costruttivi suggerimenti, al miglioramento del lavoro nel suo insieme.
Bibliografia
Abé T.H. (1967) – The armoured dinoflagellata: II. Prorocentridae and Dinophysidae (A). Pubs Seto mar. biol. Lab., 14 (5): 369-389.
Acri F, Alberghi L., Bastianini M., Bianchi F., Boldrin B., Cavalloni B., Cioce F., Comaschi A., Rabitti S., Socal G., Turchetto M.M. (1995) – Variazioni ad alta frequenza dei parametri idrologici nella laguna di Venezia. S.IT.E. Atti, 16: 31-34.
Acri F., Bernardi Aubry F., Berton A., Bianchi F., Boldrin A., Camatti E., Comaschi A., Rabitti S., Socal G. (2004) – Plankton communities and nutrients in the Venice Lagoon. Comparison between current and old data. J. Mar. Systems, 51: 321-329.
Alberighi L., Bianchi F., Cioce F., Socal G. (1992) – Osservazioni durante un bloom di Skeletonema costatum in prossimità della centrale termoelettrica ENEL di Fusi-na, Porto Marghera (Venezia). Oebalia, 17 suppl.: 321-322.
An S.S., Friedl T., Hegewald E. (1999) – Phylogenetic relationships of Scenedesmus and Scenedesmus-like coccoid green algae as inferred from IT-2 rDNA sequence comparisons. Plant Biology, 1: 418-428.
Andreoli C., Tolomio C. (1985) – Indagine preliminare sulla biomassa fitoplanctonica in Val Dogà (Laguna di Venezia). Oebalia, 11: 157-165.
Andreoli C., Tolomio C. (1988a) – Ciclo annuale del fitoplancton in una valle da pesca della Laguna di Venezia (Valle Dogà). Archo Oceanogr. Limnol., 21: 95-115.
Andreoli C., Tolomio C. (1988b) – Densité et biomasse du phytoplancton et du pico-plancton dans des bassins fertilisées en «Valle Fosse» et «Valle Zappa» (Lagune de Venise). Arch. Hydrobiol. (Algol. Studies), 49: 505-528.
Andreoli C., Tolomio C., Tonello A., Zorzetto S., Guglielmo L., Lumare F. (1986) Effetti della fertilizzazione sulle catene trofiche in due valli da pesca della Laguna di Venezia. Ambiente e risorse, 1: 37-46.
Balech E. (1974) – El genero ‹‹Protoperidinium›› Bergh, 1881 (‹‹Peridinium›› Ehren-berg,1831, partim). Rev. Mus. Argent. Cienc. Nat. ‹‹Bernardino Rivadavia›› , Hidro-biol.,4: 1-79.
Balech E. (1976) – Notas sobre el género Dinophysis (Dinoflagellata). Physis, 35 (91): 183-193.
Balech E. (1979) – El género Pyrophacus Stein (Dinoflagellata). Physis, 38 (94): 27-38.
Bandelj V., Socal G., Park Y.-S., Lek S., Coppola J., Camatti E., Capuzzo E., Dilani L., Solidoro C. (2008) – Analysis of multitrophic plankton assemblages in the Lagoon of Venice. Mar. Ecol. Progr. Ser., 368: 23-40.
Barillari A., Bianchi F., Boldrin A., Cioce F., Comaschi Saramuzza A., Rabitti S.,
Socal G. (1985) – Variazioni dei parametri idrologici, del particellato e della bio-massa planctonica durante un ciclo tidale nella laguna di Venezia. Atti 6° Congresso A.I.O.L.: 227-234.
Bernardi Aubry F., Acri F. (2004) – Phytoplanktom seasonality and exchange at the inlets of the Lagoon of Venice (July 2001 – June 2002). J. Marine Systems, 51: 65-76.
Bernardi Aubry F., Acri F., Bianchi F., Pugnetti A. (2013) – Looking for patterns in the phytoplankton community of the Mediterranean microtidal Venice Lagoon: evidence from ten years of observations. Scientia Marina, 77 (1): 47-60.
Bertrand J. (1992) – Mouvements des diatomées – I – Synthèse des mouvements. Cryp-togamie, Algol.,13: 49-71.
Bianchi F., Comaschi A., Socal G. (1998) – Ciclo annuale dei nutrienti, del materiale sospeso e del plancton nella laguna di Venezia. In: Aspetti ecologici e naturalistici dei sistemi lagunari e costieri. Boll. Mus. Civ. St. nat. Venezia, 49 suppl.: 231-240.
Bianchi F., Acri F, Alberghi L., Bastianini M., Boldrin B., Cavalloni B., Cioce F., Comaschi A., Rabitti S., Socal G., Turchetto M.M. (2000) – The Lagoon of Venice: a biological variability study. A general review. In: La ricerca scientifica per Venezia. Il Progetto Sistema Lagunare Veneziano. Vol. III. Summaries of the results of the Unesco/Murst project (Ist. Ven. Sci., Lett. ed Arti Ed.). Tip. La Garangola, Padova: 47-57
Böhm A. (1931) – Die Adriatischen Ceratien. Bot. Arch., 31: 349-385.
Bourelly P. (1970) – Les algues d’eau douce. Initiation à la systématique. III. Les algues bleues et rouges, les Eugléniens, Péridiniens et Cryptomonadines. Boubée, Paris, 512 pp.
Brown S.D. (1976) – A comparison of the attached algal communities of a natural and artificial substrata. J. Phycol., 12: 301-306.
Carazzi D., Grandori R. (1912) – Ricerche sul plancton della Laguna Veneta. Soc. Coop. Tipogr., Padova, 64 pp.
Castenholz R.W. (1961) – An evaluation of submerged glass method of estimating pro-ductin of attached algae. Verhan. Intern. Verein. theor. angew. Limnol., 14: 155-159.
Cavalier-Smith T. (1986) – The kingdom Chromista: origin and systematics. In: Pro-gress in phycological research. Vol. 4 (Round F.E. & Chapman D.J. Eds), Biopress Ltd., Bristol: 309-347.
Chrétiennot-Dinet M.J. (1990) – Chlorarachniophycées, Chlorophycées, Cryptophy-cées, Euglenophycées, Eustigmatophycées, Prasinophycées, Prymnesiophycées, Rhodophycées, Tribophycées. In: Sournia A. (ed.), Atlas du phytoplancton marin. Ed. CNRS, Paris, vol. III: 1-261.
Cioce F., Comaschi Scaramazza A., Lombardo A., Socal G. (1979) – Hydrological and biological data from the northern basin of the Venice lagoon. June 1977-June 1978. Atti Ist. Ven. Sci., Lett. ed Arti,137: 309-342.
Commissione tecnico-scientifica per la sperimentazione e i controlli periodici sulla centrale termoelettrica dell’ENEL sita in località Fusina di Porto Marghera, Venezia (1983) – Indagini idrotermodinamiche e biologiche per la valutazione dei riflessi ambientali del funzionamento a piena potenza della centrale (periodo dal 1979 al 1982). B. 3 – Fitoplancton . ENEL-DCO, Piacenza, 14 pp.
Cox E.J. (2015) – Coscinodiscophyceae, Mediophyceae, Fragilariophyceae, Bacilla-riophyceae (Diatoms). In: Syllabus of plant families. Adolf Engler’s Syllabus der pflanzenfamilien. 13th Ed. Photoautotrophic eukaryotic algae Glaucocystophyta, Cryptophyta, Dinophyta/Dinozoa, Heterokontophyta/Ochrophyta, Chloraracnio-phyta/ Cercozoa, Euglenophyta/Euglenozoa, Chlorophyta, Streptophyta (Frey W. ed.). Borntraeger Science Publishers, Berlin: 64-103.
Dale B. (1983) – Dinoflagellate resting cysts: “benthic plankton”. In: G. A. Fryxell, Survival strategies of the algae. Cambridge Univ. Press, Cambridge: 69-136.
D’Alpaos L., Di Silvio G. (1979) – Presentazione dei risultati. In: Ministero dei Lavori Pubblici (ed.), Le correnti di marea nella Laguna di Venezia, Istituto di Idraulica dell’Università, Padova, tavv. 1-22: 41-49.
D’Ancona U., Battaglia B. (1962) – Le lagune salmastre dell’Alto Adriatico, ambiente di popolamento e di selezione. Pubbl. Staz. Zool. Napoli, 32: 315-335.
Dell’Uomo A. (2004) – L’indice diatomico di eutrofizzazione/polluzione nel monito-raggio delle acque correnti. APAT, Firenze, 101 pp.
De Toni G.B. (1898) – Flora algologica della Venezia. Le Diatomee, Parte V. Atti Ist. Ven. Sci., Lett. ed Arti,8: 1051-1063.
Dodge J.D. (1965) – Thecal fine-structure in the dinoflagellate genera Prorocentrum and Exuviaella. J. mar. biol. Ass. U.K., 45 (3): 607-614.
Dodge J.D. (1975) – The Prorocentrales (Dinophyceae). II. Revision of the taxonomy within the genus Prorocentrum. Bot. J. Linn. Soc., 71: 103-125..
Dodge J.D. (1982) – Marine Dinoflagellates of the British Isles. Her Majesty’s Statione-ry Office, London, 303 pp.
Facca C., Sfriso A. (2007) – Epipelic diatom spatial and temporal distribution and relationship with the main environmental parameters in coastal waters. Estuarine, Coastal and Self Science,75: 35-49.
Facca C., Sfriso A. (2009) – Phytoplankton in a transitional ecosystem of the Northern Adriatic Sea and its putative role as an indicator for water quality assessment. Ma-rine Ecology,30: 462-479.
Facca C., Sfriso A. (2011) – Confronto tra comunità microalgali di bassofondo e di canale nella laguna di Venezia. Lavori Soc. Ven. Sc. Nat., 36: 71-79.
Facca C., Sfriso A., Socal G. (2002a) – Phytoplankton spatial and temporal distribu-tion in the central part of the Venice lagoon. Biol. Mar. Mediterr., 9 (1): 383-390.
Facca C., Sfriso A., Socal G. (2002b) – Temporal and spatial distribution of diatoms in the surface sediments of the Venice lagoon. Botanica Marina, 45: 170-183.
Facca C., Sfriso A., Socal G. (2002c) – Changes in abundance and composition of phytoplankton and microphytobenthos due to increased sediment fluxes in the Venice lagoon, Italy. Estuarine, Coastal and Shelf Science, 54: 773-792.
Facca C., Sfriso A. Socal G. (2003) – Diatomee planctoniche e bentoniche: abbondanza e diversità nella laguna di Venezia. Biol. Mar. Mediterr., 10 (2): 1006-1009.
Facca C., Sfriso A., Ghetti P.F. (2004a) – Phytoplankton community composition and distribution in an eutrophic coastal area (Venice lagoon, Italy). Acta Adriat., 45 (2): 163-180.
Facca C., Sfriso A., Ghetti P.F. (2004b) – Abbondanza e diversità del fitoplancton e delle diatomee bentoniche in laguna di Venezia. Biologia Ambientale, 18/2: 19-24.
Facca C., Bazzoni A.M., Ceoldo S., Hewes C., Holm-Hansen O., Sfriso A. Socal G. (2009) – Interazione acqua-sedimento: le microalghe della laguna di Venezia. Biol. Mar. Mediterr.,16 (1): 146-149.
Facca C., Bonometto A., Boscolo R., Sfriso A. (2013) – Planktonic and benthic microalgale in choked areas of the Venice lagoon and their relationships with water and sediment physico-chemical parameters. Biol. Mar. Mediterr., 20 (1): 210-211.
Facca C., Bilaničovà D., Pojana G., Sfriso A., Marcomini A. (2014a) – Harmful Algae Records in Venice Lagoon and il Po River Delta (Northern Adriatic Sea, Italy). Sci-ent. World J.,2014: 1-11.
Facca C., Bernardi Aubry F., Socal G., Ponis E., Acri F., Bianchi F., Giovanardi F., Sfriso A. (2014b) – Description of a Multimetric Phytoplankton Index (MPI) for the assessment of transitional zone. Mar. Poll. Bull., 79: 145-154.
Faganelli A. (1954) – Il trofismo della Laguna Veneta e la vivificazione marina. I – Ri-cerche idrografiche. Archo Oceanogr. Limnol., 9: 19-112.
Geitler L. (1932) – Cyanophyceae. In: Rabenhorst’s Kryptogamen-Flora von Deutschland, Österreich und der Schweiz. Akad. Verlags. m.b.H., Leipzig, 14: 780 pp.
Gemeinhardt K. (1930) – Silicoflagellatae. In: Rabenhorst’s Kryptogamen-Flora von Deutschland, Österreich und der Schweiz. Akad. Verlags. m.b.H., Leipzig, 10 (2): 82 pp.
Gómez F. (2013) – Reinstatement of the dinoflagellate genus Tripos to replace Neoce-ratium, marine specie of Ceratium (Dinophyceae Alveolata). CICIMAT Oceanides,28 (1): 1-22.
Guiry M.D. & Guiry G.M. (2017) – Algaebase. World-wide electronic publication. National University of Ireland, Galway.
Hendey N. I. (1964) – An introductory account of the smaller algae of British coastal wa-ters. V: Bacillariophyceae (Diatoms). Fish. Invest. Series IV, HMSO, London, 317 pp.
Huber-Pestalozzi G. (1955) – Das Phytoplankton des Süßwassers. Systematik und Biologie. 4.Teil: Euglenophyceen. E. Schweizerbart’sche Verlags., Stuttgart, 606 pp.
Hustedt P. (1930-1966) – Die Kieselalgen Deutschlands, Österreichs und der Schweiz mit Berücksichtigung der übrigen Länder Europas sowie der angrenzenden Mee-resgebiete. In: Rabenhorst’s Kryptogamen-Flora von Deutschland, Österreich und der Schweiz. Akad Verlags. M.b.H., Leipzig, 7: Tl. 1, 920 pp.; Tl. 2, 845 pp.; Tl. 3, 816 pp. (non completato).
Imhof O. E. (1886) – Uber mikroscopische pelagische Thiere aus de Lagunen von Ve-nedig. Zool. Anz., 9: 101-104.
Iserentant R. (1987) – Quelques réflexions sur la notion de périphyton. Cah. Biol. Mar.,28: 297-302.
Issel R., 1941- Note sul plancton della Laguna Veneta. Archo Oceanogr. Limnol., 1: 31-57.
Jacques G. (1979) – Phytoplancton: biomasse, production, numération et culture. Ed. du Castillet, Perpignan, 107 pp.
Kelly M.G. (1998) – Use of the trophic diatom index to monitor eutrophication in rivers. Water Res., 32: 236-242.
Krammer K., Lange-Bertalot H. (1986) – Bacillariophyceae. 2/1 – Naviculaceae. In: Süsswasserflora von Mitteleuropa (A. Pascher ed.). G. Fischer, Stuttgart, 876 pp.
Krammer K., Lange-Bertalot H. (1988) – Bacillariophyceae. 2/2 – Bacillariaceae, Epi-themaceae, Surirellaceae. In: Süsswasserflora von Mitteleuropa (A. Pascher ed.). G. Fischer, Stuttgart, 586 pp.
Krammer K., Lange-Bertalot H. (1991a) – Bacillariophyceae. 2/3 – Centrales, Fragi-lariaceae, Eunotiaceae. In: Süsswasserflora von Mitteleuropa (A. Pascher ed.). G. Fischer, Stuttgart, 576 pp.
Krammer K., Lange-Bertalot H. (1991b) – Bacillariophyceae. 2/4 – Achnanthaceae, Kritische Ergänzungen zu Navicula (Lineolatae) und Gomphonema Gesamtlitera-turverzeichnis. In: Süsswasserflora von Mitteleuropa (A. Pascher ed.). G. Fischer, Stuttgart, 437 pp.
Kretschmann J., Elbräcter M., Zinssmeister C., Soehner S., Kirsch M., Kusber W.-H., Gottschling M. (2015) – Taxonomic clarification of the dinophyte Peridiniun acuminatum Ehrenberg, ? Scrippsiella acuminata. com. nov (Thoracosphaeraceae,Peridiniales). Phytotaxa 220 (3): 239-256.
Kützing F.T. (1865) – Die kieselschaligen Bacillarien oder Diatomeen. Verlag F. För-stermann, Nordhausen, 152 pp.
Lebour M.V. (1925) – The dinoflagellates of the Northern seas. Mar. Biol. Ass. U.K., Plymouth, 250 pp.
Lemmermann E., Brunnthaler J., Pascher A. (1915) – Chlorophyceae II . In: Süsswas-ser-Flora Deutschlands, Österrreichs und der Schweiz (A. Pascher ed.). G. Fischer, Jena, 5, 250 pp.
Lenzi Grillini C., Solazzi A., Tolomio C. (1978) – Norme per la raccolta, la conser-vazione e lo studio del fitoplancton. In: G. Magazzù (ed.), Metodi per lo studio del plancton e della produzione primaria. Editrice GM., Messina: 9-17.
Levkov Z. (2009) – Amphora sensu lato. In: Lange-Bertalot H. (ed.), Diatoms of Europe: Diatoms European Inland Waters and Comparable Habitats. A.R.G. Gantner
Verlag K.G., Ruggel, Vol. 5: 5-916.
Lohmann H. (1911) – Über das Nannoplankton und die Zentrifugieruntkleinster Was-serprobenzur Gewinnung desselben in lebendem Zustande. Intern. Rev. der ges. Hydrobiol. und Hydrogr.,4: 1-38.
Ludes B., Coste M. (1996) – Diatomées et médicine légale. Ed. Méd. Intern., Paris, 258 pp.
Lund J. W. G. (1951) – A sedimentation technique for counting algae and other organ-isms. Hydrobiologia, 3: 390-394.
Lund J. W. G., Kipling C., Le Cren E.D. (1958) – The inverted microscope method of estimating algal numbers and the statistical basis of estimations by counting. Hydrobiologia.,11: 143-170.
Marchesoni V. (1954) – Il trofismo della Laguna Veneta e la vivificazione marina. III e Ricerche sulle variazioni quantitative del fitoplancton. Archo Oceanogr. Limnol., 9: 153-285.
Martens G., 1824 – Reise nach Venedig. Stettin’schen Buchhandlung, Ulm, 664.
Medlin L.K., Kaczmarska I. (2004) – Evolution of the diatoms: V. Morphological and cytological support of the major clades and a taxonomic revision. Phycologia, 43: 245-270.
Migliardi O’Riordan V. (1915) – Ulteriore contributo alla conoscenza del plancton della Laguna Veneta. Zool. Anz., 45: 165-170.
Migliardi O’Riordan V. (1925) – Sul fitoplancton della Laguna Veneta. Atti Acc. Vene-to-trentino-istriana, 15: 21-42.
Moschin E., Moro I. (1996) – Osservazioni morfologiche su Skeletonema costatum (Greville) Cleve in un fenomeno di fioritura nella laguna di Venezia. Boll. Mus. Civ. St. nat. Venezia,45: 211-220.
Naccari F.L. (1828) – Flora veneta, o descrizione delle piante che nascono nella provin-cia di Venezia. L. Bonvecchiato, Venezia, 37 pp.
Navarro J.N. (1981a) – A survey of the Marine Diatoms of Puerto Rico. I. Suborders Coscinodiscinae and Rhizosoleniineae. Botanica Marina, 24: 427-439.
Navarro J.N. (1981b) – A survey of the Marine Diatoms of Puerto Rico. II. Suborder Biddulphiineae:: Families Biddulphiaceae, Lithodesmiaceae and Eupodiscaceae. Botanica Marina,24: 615-630.
Navarro J.N. (1982a) – A survey of the Marine Diatoms of Puerto Rico. III. Suborder Biddulphiineae: Family Chaetoceraceae. Botanica Marina, 25: 305-319.
Navarro J.N. (1982b) – A survey of the Marine Diatoms of Puerto Rico. IV. Suborder Araphidineae: Families Diatomaceae and Protoraphidaceae. Botanica Marina, 25: 247-263.
Navarro J.N. (1982c) – A survey of the Marine Diatoms of Puerto Rico. V. Suborder Raphidineae: Families Achnanthaceae and Naviculaceae (excluding Navicula and Mastogloia). Botanica Marina,25: 321-338.
Navarro J.N. (1983a) – A survey of the Marine Diatoms of Puerto Rico. VI. Suborder Raphidineae (Genera Haslea, Mastogloia and Navicula). Botanica Marina, 26: 119-136.
Navarro J.N. (1983b) – A survey of the Marine Diatoms of Puerto Rico. VII. Suborder Raphidineae: Families Auriculaceae, Epithemiaceae, Nitzschiaceae and Surirellace-ae. Botanica Marina, 26: 393-408.
Okada H., McIntyre A. (1977) – Modern Coccolithophores of the Pacific and North Atlantic Oceans. Micropaleontology, 23: 1-55.
Peragallo H. (1890-1891) – Monographie due genre Pleurosigma et des genres alliés. Ed. J. Tempère, Paris, 35 pp.
Peragallo H., Peragallo H.M. (1897-1908) – Diatomées marines de France et des districts maritimes voisins. Ed. J. Tempère, Grez-sur-Loing, 491 pp.
Prescott G.W. (1962) – Algae of the Western Great lakes area. Wm. C. Brown Co. Publisher, Dubuque, 977 pp.
Rampi L., Bernhard M. (1978) – Key for the determination of mediterranean pelagic diatoms. CNEN-RT/BIO (78) 1, 71 pp.
Rampi L., Bernhard M. (1980) – Chiave per la determinazione delle peridinee pelagiche mediterranee. CNEN-RT/BIO (80) 8, 193 pp.
Rampi L., Bernhard M. (1981) – Chiave per la determinazione delle coccolitoforidee mediterranee. CNEN-RT/BIO (81) 13, 98 pp.
Ranzoli R. (1954) – Il trofismo della Laguna Veneta e la vivificazione marina. II – Ri-cerche sulle variazioni quantitative dello zooplancton. Archo Oceanogr. Limnol., 9: 114-145.
Riaux C, Germain H. (1980) – Peuplement de diatomées épipéliques d’une slikke de Bretagne Nord. Importance relative du genre Cocconeis Ehr. Cryptogamie Algol., 1 (4): 265-279.
Ricard M. (1987) – Diatomophycées. In: Sournia A. (ed.), Atlas du phytoplancton marin. Ed. CNRS, Paris, vol. II: 1-297.
Rothmaler W. (1951) – Die Abteilungen und Klassen der Pflanzen. Feddes Repert. Spec. Nov. Regni Veg.,54: 256-266.
Round F.E., Crawford R.M., Mann D.G. (1990) – The Diatoms, Biology & Morpholo-gy of the Genera. Cambridge University Press, Cambridge, 747 pp.
Sacchi C.F. (1995) – Le lagune costiere come ambienti di transizione. S.IT.E. Atti, 16:149-154.
Sarno D., Kooistra W.C.H.F., Medlin L.K., Percopo I., Zingone A. (2005) – Diversity in the genus Skeletonema (Bacillariophyceae). II. An assessment of the taxonomy S. costatum-like species, with the description of four new species. J. Phycol.,41:151-176.
Schiller J. (1930) – Coccolithinae. In: Rabenhorst’s Kryptogamen-Flora von Deutsch-land, Österreich und der Schweiz. Akad Verlags. m.b.H., Leipzig, 273 pp.
Schiller J. (1933-1937) – Dinoflagellatae (Peridineae). In: Rabenhorst’s Kryptogamen-Flora von Deutschland, Österreich und der Schweiz. Akad Verlags. m.b.H., Leip-zig, 10: Tl 1, 617 pp.; Tl. 2, 589 pp.
Sfriso A., Pavoni B. (1994) – Macroalgae and phytoplankton competition in the central Venice lagoon. Environ Technol., 15: 1-14.
Sfriso A., Pavoni B., Marcomini A. (1989) – Macroalgae and phytoplankton standing crops in the central Venice lagoon: primary production and nutrient balance. Sci. Total Environ.,80: 139-159.
Sfriso A., Facca C., Ghetti P.F. (2007) – Rapid Quality Index, based mainly on Mac-rophyte Associations (R-MAQI), to assess the ecological status of the transitional environments. Chem. and Ecol., 23: 493-503.
Sfriso A., Facca C., Ghetti P.F. (2009) – Validation of the Macrophyte Quality Index (MaQI) set up to assess the ecological status of Italian marine transitional environ-ments. Hydrobiologia, 617: 117-141.
Sieburth J.M., Johnson P.W., Hargraves P.E. (1988) – Ultrastructure and ecology of Aureococcus anophagefferens gen. et sp. nov. (Chrysophyceae): The dominant pico-plankter during a bloom in Narragansett Bay, Rhode Island, summer 1985. J. Phy-col.,24: 416-425.
Silva P.C. (1980) – Names of classes and families of living algae, with special reference to their uso in the Index Nominum Genericorum (Plantarum). Regnum vegetabile, 103: 1-156.
Silva P.C., Throndsen J., Eikrem W. (2007) – Revisiting the nomenclature of haptophy-tes (Commentary). Phycologia, 46: 471-475.
Siver P.A. (1977) – Comparison of attached diatom communities on natural and artifi-cial substrates. J. Phycol., 13: 402-406.
Sladeckova A. (1962) – Limnological investigations methods for the periphyton (“Auf-wuchs”) community. Bot. Rev., 28: 286-350.
Socal G. (1981) – Nota sulla distribuzione quantitativa del fitoplancton nel bacino settentrionale della laguna di Venezia. Ist. Ven. Sci., Rapporti e Studi, 8: 105-119.
Socal G., Ghetti L., Boldrin A., Bianchi F. (1985) – Ciclo annuale del fitoplancton nel portocanale di Malamocco. Laguna di Venezia. Atti Ist. Ven. Sci., Lett. ed Arti, 143: 15-30.
Socal G., Pellizzato M., Da Ros L. (1986) – Analisi qualitativa del fitoplancton in acque utilizzate per la molluschicoltura (Laguna di Venezia-bacino meridionale). Lavori Soc. Ven. Sc. Nat.,11: 143-150.
Socal G., Bianchi F, Comaschi Scaramazza A., Cioce F. (1987) – Spatial distribution of plankton communities along a salinity gradient in the Venice lagoon. Archo Oceanogr. Limnol.,21: 19-43.
Socal G., Bianchi F., Alberighi L. (1989) – Evoluzione dei blooms fitoplanctonici nel bacino centrale della Laguna Veneta (1987). In: Indagini idrotermodinamiche e bio-logiche per la valutazione dei riflessi ambientali del funzionamento a piena potenza della centrale. Periodo dal 1985 al 1988 (Commissione tecnico-scientifica per la sperimentazione e i controlli periodici sulla centrale termoelettrica dell’ENEL sita in località Fusina di Porto Marghera ed.),. Venezia: 1-19.
Socal G., Bianchi F., Alberighi L. (1999) – Effects of thermal pollution and nutrient discharges on a spring phytoplankton bloom in the industrial area of the lagoon of Venice. Vie Milieu, 49 (1): 19-31.
Socal G., Acri F., Bernardi Aubry F., Bianchi F., Capuzzo E., Coppola J., Facca C.,
Sfriso A. (2006) – Serie temporali dei popolamenti fitoplanctonici dal 1977 al 2004. Biol. Mar. Mediterr.,13: 178-184.
Socal G, Buttino I., Cabrini M., Mangoni O., Penna A., Totti C. (ed.) (2010) – Metodi di studio del plancton marino. ISPRA, Manuali e linee guida 56/2010. Tipoli-tografica CSR, Roma, 623 pp.
Sournia A. (1967a) – Le genre Ceratium (péridinien planctonique) dans le Canal de Monzambico. Contribution à une révision mondiale. Première Partie. Vie Milieu, 18 (2): 375-440.
Sournia A. (1967b) – Le genre Ceratium (péridinien planctonique) dans le Canal de Monzambico. Contribution à une révision mondiale. Vie Milieu, 18 (3): 441-499.
Sournia A. (ed.)(1978) – Phytoplankton manual. UNESCO Monography on Oceano-graphic Methodology, Paris, 337 pp.
Sournia A. (1986) – Introduction, Cyanophycées, Dictyochophycées, Dinophycées, Raphidophycées. In: Sournia A. (ed.), Atlas du phytoplancton marin. Ed. CNRS, Paris, vol. I: 1-219.
Steidinger K. A. & Davis J. T. (1967) – The genus Pyrophacus, with a description of a new form. Florida Bd Conserv. Mar. Lab., N.S. I, 1 (3): 1-8.
Teodoro G. (1925) – Primo contributo alla conoscenza dei Dinoflagellati della Laguna Veneta. Atti R. Ist. Ven. Sci., 84: 591-597.
Throndsen J. (1997) – The Planktonic Marine Flagellates. In: Tomas C. (ed.), Identifying Marine Phytoplankton. Academic Press, S. Diego: 591-729.
Tolomio C. (1976 a) – Problematica e dinamica del fitoplancton nelle acque salmastre. Archo Oceanogr. Limnol.,18 suppl. 3: 343-356.
Tolomio C. (1976b) – Su alcuni ritrovamenti di Silicoflagellate nel comprensorio adria-tico. Atti Ist. Ven. Sc., Lett. ed Arti, 134: 209-219.
Tolomio C. (1977a) – La laguna salmastra e le sue alghe. Natura e Montagna, 3: 31-39. Tolomio C. (1977b) – Diatomee e Dinoflagellate in tre lagune adriatiche a diverso regime idrico. Riv. di Idrobiol., 16: 199-210.
Tolomio C. (1978) – Catalogo delle Diatomee e delle Peridinee più significative segna-late nelle acque salmastre italiane. Mem. Biol. Mar. e Oceanogr., 8: 129-150.
Tolomio C. (1983-84) – Struttura delle comunità a microalghe nelle acque mixoaline del Mare Adriatico. Nova Thalassia, 6 suppl.: 165-183.
Tolomio C. (1988) – Il fitoplancton della Valle di Brenta (Laguna di Venezia). Indagini stagionali: Giugno 1980-Marzo 1982. Archo Oceanogr. Limnol., 21: 117-150.
Tolomio C. (1993) – Courants de marée et communautés phytoplanctoniques du Ca-nale delle Trezze (Lagune de Venise). Vie Milieu, 4: 13-26.
Tolomio C. (2002) – Un ecotono emblematico: la laguna di Venezia. Chioggia, 20: 61-74. Tolomio C. (2003) – « Plume » del fitoplancton defluente dal porto-canale di Chioggia (Laguna di Venezia). Lavori Soc. Ven. Sc. Nat., 28: 33-43.
Tolomio C. (2004a) – Sul fitoplancton del bacino nord della Laguna di Venezia (Ricer-che stagionali in fase di quadratura e di sizigia). Lavori Soc. Ven. Sc. Nat., 29: 37-46.
Tolomio C. (2004 b) – Approche expérimentale pour l’étude des diatomées des sédi-ments de la Lagune de Venise, Italie. Diatom Res., 19: 81-101.
Tolomio C. (2004-2007a) – Prove sperimentali sui metodi per lo studio delle diatomee bentoniche di substrato duro. Riv. di Idrobiol., 43: 135-147.
Tolomio C. (2004-2007b) – Osservazioni su campioni di diatomee planctoniche e ben-toniche della Laguna di Venezia. Primo contributo: bacino meridionale. Riv. di Idro-biol.,43: 26-37.
Tolomio C. (2004-2007c) – Osservazioni su campioni di diatomee planctoniche e ben-toniche della Laguna di Venezia (Secondo contributo: bacino settentrionale). Riv. di Idrobiol.,43: 55-66.
Tolomio C. (2007) – Fitoplancton della Laguna di Venezia. IV. Breve nota sulle asso-ciazioni fitoplanctoniche in un canale del centro storico di Chioggia (bacino sud). Lavori Soc. Ven. Sc. Nat.,32: 43-48.
Tolomio C. (2008) – Rassegna delle segnalazioni di microalghe tossiche o potenzialmente tossiche nei bacini salmastri dell’Alto Adriatico. Lavori Soc. Ven. Sc. Nat., 33: 47-57.
Tolomio C. (2016a) – Colonizzazione delle diatomee su differenti tipi di substrato. Lavori Soc. Ven. Sc. Nat., 41: 33-49.
Tolomio C. (2016b) – Diatomee epilitiche nella Laguna di Venezia. Lavori Soc. Ven. Sc. Nat.,41: 51-65.
Tolomio C., Andreoli C. (1989) – Recherches sur le periphyton à Diatomées dans un vivier de la Lagune de Venise (mai 1984-mai 1985). Diatom Res., 4: 151-162.
Tolomio C., Bullo L. (2001a) – Prelievi giornalieri di fitoplancton in una stazione del bacino di Chioggia (Laguna di Venezia). Aprile 1993-Marzo 1994. Boll. Mus. civ. St. nat. Venezia,51: 3-23.
Tolomio C., Bullo L. (2001b) – Analisi qualitativa del fitoplancton in tre siti a diverso regime idrologico (Marzo 1995-Giugno 1996). Lavori Soc.Ven. Sc. Nat., 26: 29-52.
Tolomio C., Bullo L. (2001c) – Influenza delle maree di sizigie e di quadratura sulle comunità fitoplanctoniche in una stazione del bacino di Chioggia (1997). Lavori Soc. Ven. Sc. Nat.,26: 53-69.
Tolomio C., Bullo L. (2006) – Un quadriennio di ricerche sul fitoplancton nel bacino sud della Laguna di Venezia (1998-2001). Boll. Mus civ. St. nat. Venezia, 57: 3-27.
Tolomio C., Cavolo F. (1985a) – Presenza di Coolia monotis Meunier (Dinophyceae, Peridiniales) nelle acque della Laguna di Venezia. Oebalia, 11: 849-852.
Tolomio C., Cavolo F. (1985b) – Description de Prorocentrum venetum sp. nov. (Dino-phyceae) trouvée dans la Lagune de Venise. Botanica Marina, 28: 345-349.
Tolomio C., Moschin E. (1994) – Bellerochea malleus (Brigthwell) Van Heurck f. bian-gularis Von Stosch, una diatomea rara rinvenuta nelle acque della Laguna di Vene-zia. Boll. Mus. Civ. St. nat. Venezia, 43: 235-243.
Tolomio C., Moschin E. (1995a) – Y a-t-il des microalgues nuisibles dans la Lagune de Venise? (Période des observations: 1988-1993). Marine Life, 5 (1): 3-9.
Tolomio C., Moschin E. (1995b) – Activités de recherche sur les Diatomées benthiques dans la lagune de Venise: approche méthodologique. Rapp. Comm. int. Mer Médit., 34: 87.
Tolomio C., Moschin E. (2006) – Caratterizzazione stagionale delle comunità fitoplan-ctoniche nel bacino centrale della Laguna di Venezia. Lavori Soc.Ven. Sc. Nat., 31: 37-51.
Tolomio C., Moschin E. (2007) – Fitoplancton de la Lagune de Venise. III – Canaux de Pellestrina et de S. Pietro (avril 1990-mars 1991). Lavori Soc. Ven. Sc. Nat., 32: 33-41.
Tolomio C., Andreoli C., Avignone M.T. (1991) – Contribution à la connaissance du periphyton diatomique des eaux saumâtres de la Valle Sparesera (Suite). Diatom Res.,6: 391-399.
Tolomio C., Andreoli C., Moro I., Moschin E., Scarabel L., Masiero L. (1996) –
Communautés phytoplanctoniques dans le bassin méridional de la Lagune de Ve-nise (février 1991-janvier 1993). Marine Life, 6 (1/2): 3-14.
Tolomio C., Moro I., Moschin E., Valandro A. (1999a) – Résultats préliminaires sur les Diatomées benthiques des substrats meubles dans la Lagune de Venise, Italie (mars 1994-janvier1995). Diatom Res., 14 (2): 367-379.
Tolomio C., Moschin E., Moro I., Andreoli C. (1999b) – Le phytoplancton de la Lagune de Venise. I – Bassin septentrional et bassin méridional (avril 1988-mars 1989). Vie Milieu, 49 (1), 33-44.
Tolomio c. Andreoli C., Moschin E., Moro I. Masiero L. (2000a) – Studi pluriennali sulle microalghe della laguna di Venezia. Sintesi dei risultati. In: La ricerca scienti-fica per Venezia. Il Progetto Sistema Lagunare Veneziano. Vol. II, Tomo II. Model-listica del Sistema Lagunare. Sudio di Impatto Ambientale (Ist. Ven. Sci., Lett. ed Arti ed.). Tip. La Garangola, Padova: 1099-1115.
Tolomio C., Moschin E., Moro I., Valandro A. (2000b) – Approccio allo studio delle diatomee bentoniche nei sedimenti della laguna di Venezia. In: La ricerca scientifica per Venezia. Il Progetto Sistema Lagunare Veneziano. Vol. II, Tomo II. Modellistica del Sistema Lagunare. Sudio di Impatto Ambientale (Ist. Ven. Sci., Lett. ed Arti ed.). Tip. La Garangola, Padova: 1145-1153.
Tolomio C., Moschin E. Duzzin B. (2002a) – Distribution des diatomées benthiques de substrats meubles dans le bassin sud de la lagune de Venise, Italie. Diatom Res., 17: 401-414.
Tolomio C., Moschin E., Moro I. (2002b) – La microflora planctonica della Laguna di Venezia. Bacino meridionale: gennaio 1993-dicembre 1994. Boll. Mus. civ. St. nat. Venezia,53: 3-22.
Tolomio C., Moschin E., Moro I. (2002c) – Variazioni del fitoplancton in corpi idrici in movimento lungo i canali Poco Pesce – Novissimo (Laguna di Venezia, bacino meridionale). Lavori Soc. Ven. Sc. Nat., 27: 73-84.
Tolomio C., Moschin E., Moro I. (2004-2007) – Cicli nictemerali stagionali nella Laguna di Venezia, bacino di Chioggia (Idrologia e fitoplancton). Riv. di Idrobiol., 43: 42-54.
Tolomio C., Masiero L., Moro I., Moschin E. (2005) – Influenza della marea sul fi-toplancton e su alcune variabili ambientali in Valle di Brenta (Laguna di Venezia). Boll. Mus. civ. St. nat. Venezia,56: 3-24.
Tolomio C., Moschin E., Moro I. (2006) – Le phytoplancton de la Lagune de Venise. II – Bassin central (avril 1989-mars 1990). Lavori Soc. Ven. Sc. Nat., 31: 25-35.
Tolomio C., Tassoni T., Duzzin B. (2009) – Ulteriori indagini su fitoplancton e pa-rametri ambientali per la descrizione dell’ambiente lagunare (bacino di Chioggia) mediante analisi multivariata. Lavori Soc. Ven. Sc. Nat., 34: 47-59.
Tomas C. (1997) – Identifying Marin Phytoplankton. Academic Press, S. Diego, 858 pp. Travers M. (1973) – Le microplancton du Golfe de Marseille: variations de la composition systématique et de la densité des populations. Téthys, 5: 31-53.
Utermöhl H. (1931) – Über das umgekehrte Mikroscop. Arch. Hydrobiol., 22: 643-645.
Utermöhl H. (1958) – Vervollkommnung der quantitativen Phytoplankton-Methodik. Mitt. int. Verein. theor. angew. Limnol.,9: 1-38.
Van der Werff A., Huls H. )1957-1974) – Diatomeeënflora van Nederland. Den Haag, afl. 1.10.
Van Heurck H. (1890-1891) – Synopsis des Diatomées de Belgique. Ed. H. Van Heur-ck, Anversa, Pl. CXXXII.
Van Heurck H. (1899) – Traité des Diatomées. Ed. H. Van Heurck, Anversa, 572 pp. Van Landingham S.L. (1967-1979) – Catalogue of the fossil and recent genera and species Diatoms and their synonyms. J. Cramer, Lehre, 1-8: 4654 pp.
Voltolina D. (1970) – Fioritura di fitoplancton nella laguna veneta. Archo Oceanogr. Limnol.,16: 275-279.
Voltolina D. (1973a) – A phytoplankton bloom in the lagoon of Venice. Archo Oce-nogr. Limnol.,18: 19-37.
Voltolina D. (1973b) – Phytoplankton concentrations in the Malamocco channel of the lagoon of Venice. Archo. Ocenogr. Limnol., 18: 1-18.
Voltolina D. (1973c) – Osservazioni sulla composizione del fitoplancton durante un fenomeno di fioritura nella laguna di Venezia. Atti Ist. Ven. Sci., Lett. ed Arti, 131: 119-146.
Voltolina D. (1974) – Il fitoplancton della laguna di Venezia. Boll. Mus. Civ. St. nat. Venezia,26: 81-86.
Voltolina D. (1975a) – The phytoplankton of the lagoon of Venice: November 1971-November 1972. Pubbl. Staz. Zool. Napoli, 39: 206-340.
Voltolina D. (1975b) – Thalassiosira annaliae, a new diatom from the lagoon of Venice. Pubbl. Staz. Zool. Napoli, 39: 201-205.
Wall D. & Dale B. (1971) – A reconsideration of living and fossil Pyrophacus Stein, 1883 (Dinophyceae). J. Phycol., 7 (3): 221-235.
Willen E. (1976) – A semplified method of phytoplankton counting. Br. Phycol., 11: 265-278.
Wynne M.J. & Hallan J.K. (2015) – Reinstatement of Tetradesmus G.M. Smith (Sphaeropleales, Chlorophyta). Feddes Repert. Spec. Nov. Regni Veg., 126: 83-86.
Zanardini G. (1847) – Notizie intorno alle alghe cellulari marine delle Lagune e dei litorali di Venezia. Tip. P. Naratovich, Venezia, 88 pp.
Zanon V. (1937) – Le Diatomee della laguna e del mare di Venezia. Atti Soc. It. Progr. delle Scienze,5: 183-191.
Zanon V. (1938) – Le alghe della Laguna di Venezia. Sez. II: Bacillarieae. In: La Laguna di Venezia (Monografia). Tip. C. Ferrari, Venezia, 3: 551 pp.
Zingone A., Honsell G., Marino D., Montresor M., Socal G. (1990) – Fitoplancton. In: M. Innamorati, I. Ferrari, D. Marino, M. Ribera D’Alcalà (ed.), Metodi nell’ecologia del plancton marino. Edizioni LINT, Trieste: 183-198.
Zingone A., Percopo I., Sims P.A., Sarno D. (2005) – Diversity in the genus Skeletone-ma (Bacillariophyceae). I. A reexamination of the type material of S. costatum withthe description of S. grevillei sp. nov.. J. Phycol., 41: 140-150.
