Riassunto
Nel corso del 2012-2016 sono state effettuate 36 visite ad uno stagno artificiale d’acqua dolce, di circa sei ettari, realizzato nei primi anni Duemila in una vasta isola artificiale posta nel baci-no centrale della laguna di Venezia. Sono state osservate 72 specie, di cui 51 non Passeriformi e 21 Passeriformi. Quindici specie sono incluse nell’Allegato I della Direttiva Uccelli 147/09/ CE, mentre 18 sono considerate “minacciate” nella Lista Rossa degli uccelli nidificanti in Italia. Tredici le specie di Anseriformi; la loro abbondanza raggiunge un picco in febbraio, mentre la ricchezza specifica si mantiene ai livelli maggiori tra febbraio e aprile. Germano reale (Anas platyrhynchos), alzavola (Anas crecca) e canapiglia (Anas strepera) sono state le specie di Anatidipiù abbondanti. È stata accertata la nidificazione di specie di interesse conservazionistico e rare a livello regionale quali fistione turco (Netta rufina), falco di palude (Circus aeruginosus), salciaiola (Locustella luscinioides). Aree umide artificiali come quella considerata si dimostrano utili per favorire la presenza e la nidificazione di numerose specie di uccelli.
Abstract
Birds of an artificial fresh water pond made in the lagoon of Venice (Italy)
Between 2012 and 2016 thirty-six visits were done to a man-made freshwater pond, six ha in size and about ten years old, made inside a large artificial island located in the central lagoon of Venice. Seventy-two species were observed, among which 51 were non-Passerines and 21 Passerines; 18 species are listed in the Annex I of the 147/09/EC Birds Directive. Thirteen species of Anatidae occurred throughout the year; abundance reached a peak in February, while the richness was the highest between February and April. Mallard (Anas platyrhynchos), Teal (Anas crecca) and Gadwall (Anas strepera) were the most abundant ducks. Several species of conservation concern, such as Red-crested Pochard (Netta rufina), Marsh Harrier (Circus aeruginosus) and Savi’s Warbler (Locustellaluscinioides) nested in the study area. Artificial ponds like the one studied may be important for enhancing the occurrence of several species of birds, and ducks in particular, throughout the year.
Introduzione
Gli interventi di creazione o di ripristino di specchi d’acqua dolce sono stati nel Veneto piuttosto numerosi negli ultimi venti anni. Gli scopi prefissi erano svariati ed in parte sovrapponibili: creazione di habitat importanti per la fauna e in particolare per l’avifauna (Valle Vecchia di Caorle-VE); riduzione mediante fitodepurazione del carico di nutrienti di fiumi (Ca’ di Mezzo, Codevigo-PD; Castelnovo Bariano-RO; Cave senili di Salzano e di Noale-VE) o di acque reflue già sottoposte a trattamento convenzionale (Cassa di colmata A di Mira-VE); ritenzione delle acque di prima pioggia sversate da infrastrutture viarie (specchi d’acqua lungo il cosiddetto Passante di Mestre-VE e TV). Infine, alcuni corpi idrici sono stati realizzati ed altri sono in fase di completamento per la lamina-zione delle acque di piena (Caldogno e Arzignano-VI; Mogliano Veneto-TV).
Gli effetti complessivamente positivi di questi interventi, riassumibili in un aumento locale della ricchezza specifica e dell’abbondanza di animali vertebrati ed invertebrati, nell’abbattimento del carico di inquinanti e di solidi sospesi nelle acque e non da ultima la creazione di siti utilizzabili per lo svago e il tem-po libero, sono spesso citati, benché la disponibilità di dati empirici a supporto di tali affermazioni sia molto variabile. Se gli aspetti fisico-chimici relativi alla qualità delle acque e dei sedimenti sono stati esaminati in dettaglio (Dal Cin et al., 2002;ISPRA,2012;VenetoAgricoltura, 2014), poca attenzione è statarivolta agli aspetti faunistici, che pure meriterebbero ben maggiore rilievo. Per un esame dell’importanza che le zone umide artificiali possono avere per l’avi-fauna si vedano ad esempio per l’Italia i lavori di Kravos et al., 2014; Marchesi & Tinarelli, 2007; Di Santo et al., 2015. All’estero la bibliografia scientifica relativa alla fauna delle zone umide artificiali è peraltro molto ricca; si vedano per alcune sintesi i lavori di Hansson et al., 2005; Murray et al., 2010; Brand & Snodgrass, 2010; Hsu et al., 2011; Sirami et al., 2013.
Tralasciando alcuni opuscoli divulgativi, le pubblicazioni scientifiche riguardo la fauna che si è insediata nelle zone umide artificiali realizzate nel Veneto ne-gli ultimi venti anni sono sorprendentemente poche; tra le eccezioni si citano Sgorlon (2016) e Scarton et al. (in stampa) per quanto concerne l’avifauna. Del tutto assente qualsiasi indagine più complessa sotto il profilo teorico, come ad esempio l’analisi dei servizi ecosistemici che pure queste zone umide certamente svolgono, per analogia con quanto noto per simili biotopi (D’Antoni et al., 2011). Agli inizi degli anni Duemila è stato scavato nella Cassa di colmata D/E, vasta isola artificiale sita nel bacino centrale della laguna di Venezia, uno stagno destinato a favorire la presenza dell’avifauna legata ai corpi idrici d’acqua dolce. Di seguito si presentano e discutono i risultati di osservazioni ornitologiche condotte per un quadriennio in quest’area.
Area di studio e metodi
La Cassa di colmata D/E, ubicata nel bacino centrale della laguna di Venezia (comune di Mira, VE; coordinate baricentro N 45°22’03’’; E 12°14’05’) ha un’e-stensione di circa 750 ettari. Assieme alle Casse di colmata A e B è stata realizzata negli anni Sessanta del secolo scorso per colmamento di aree lagunari con i fanghi provenienti dal dragaggio del Canale Malamocco-Marghera (Semenzato, 2002; Scarton et al., 2000). La Cassa D/E è delimitata da argini, con varchi creatisi in più punti, ed è attraversata interamente da due ampi canali di sezione pari a circa 40 m, scavati all’inizio degli anni Novanta del secolo scorso per favorire la circolazione idrica nelle zone retrostanti.
Per quanto riguarda gli aspetti vegetazionali, è possibile suddividere la cassa D/E in tre grandi settori: 1) aree lungo il settore occidentale, poco o per nulla interessate dall’imbonimento e che hanno in gran parte conservato le caratteristiche naturali precedenti, con presenza di vegetazione alofila e di stagni salmastri; 2) aree boscate, con esemplari di dimensioni medio-grandi di Populus sp., Salix sp. e Betula pendula, sviluppatesi soprattutto nei settori piùinterni e rilevati; 3) vaste superfici pianeggianti, che costituiscono il settore più esteso dominato da vegetazione di tipo mesofilo (ad es. Agropyron pungens, Calamagrostis epigejos) o nelle aree più depresse e fortemente imbibite di tipoelofilo (Juncus sp., Carex sp., Bolboschoenus sp., Phragmites australis). Alla fine degli anni Novanta nella Cassa D/E erano presenti solo pochi stagni a debole salinità, spesso circondati da canneti e con estensione complessiva di circa sei ettari; la scarsità di corpi idrici d’acqua dolce e perenni costituiva un limite alla presenza dell’avifauna più legata a questa tipologia di habitat, come risultava da indagini ornitologiche effettuate da Scarton et al. (2000) nel 1998.
Nel 1997 venne siglato uno specifico accordo di programma tra numerosi Enti pubblici competenti territorialmente, finalizzato all’esecuzione di un’articolata serie di interventi di protezione e miglioramento ambientale nelle Casse di col-mata (Comune di Mira, 2007). Tra il 2002 ed il 2003 venne pertanto realizzato nella Cassa D/E lo scavo di uno stagno artificiale, dotato di punti di osservazione dell’avifauna schermati, e un sentiero natura, che contornava lo stagno ed era attrezzato con pannelli interpretativi relativi alle caratteristiche faunistiche ed ambientali dell’area. L’accordo prevedeva anche l’esecuzione per alcuni anni del monitoraggio della vegetazione e della fauna nelle aree di intervento, di cui però finora non è stato possibile reperire i risultati.
Alla fine del 2016 lo stagno presentava un’estensione di 5.6 ettari ed un peri-metro di circa 1 km; la profondità risultava variabile ma mai superiore al metro. Al centro dello stagno era presente un isolotto di circa 0.20 ettari. Lo stagno è alimentato esclusivamente da acque meteoriche; il fondale è stato impermeabi-lizzato con bentonite al fine di limitare le perdite per infiltrazione. Lo stagno può presentarsi del tutto ghiacciato in inverno, mentre nella siccitosa estate del 2012 si è completamente prosciugato. La vegetazione si è sviluppata esclusivamente per processi colonizzativi naturali; le rive sono attualmente in parte orlate da fragmiteto, mentre i fondali presentano coperture di Ruppia sp.pl. e da alghe verdi dei generi Enteromorpha e Chaetomorpha. Lungo il margine meridionale e occidentale le rive risultano invece ricoperte da un fitto popolamento di Baccharis halimifolia, specie invasiva di origine nord americana. Nuclei arborei preesistentiallo scavo sono presenti al margine orientale dello stagno e sono composti pre-valentemente da pioppo nero Populus nigra e salice bianco Salix alba.
Lo stagno è situato in posizione defilata rispetto ad uno dei due grandi canali in-terni alla Cassa di colmata, a circa 400 m da un pontile di sbarco da cui si diparte un sentiero che conduce allo stagno. Lo stagno è incluso sia nella ZPS IT3250046 Laguna di Venezia che nel SIC IT325030 Laguna medio-inferiore di Venezia: la caccia vi è formalmente vietata, essendo posto all’interno dell’Oasi di Protezione ”Cassa di colmata D/E”, per quanto non sia stato raro trovare sul terreno bossoli di proiettili da caccia. Per alcuni anni sono state organizzate da Enti ed Associazioni visite guidate allo stagno ed alle aree contermini, per adulti e studenti.
Sopralluoghi occasionali presso lo stagno sono stati condotti dall’autore sin dal 2004, ma con maggior regolarità nel periodo maggio 2012-settembre 2016. In questo arco temporale si sono svolte 36 visite, ognuna delle quali di circa un’ora, tra le 8 e le 13; si è annotata la presenza di tutte le specie, mentre si sono conteg-giati gli individui delle sole specie acquatiche. I risultati si riferiscono alla sola area dello stagno e, con rare eccezioni di seguito specificate, per il periodo sopra indicato; non sono stati inclusi gli individui in volo alto e direzionale. Poiché le visite sono state svolte anche nell’ambito di altre e diverse indagini effettuate nella laguna centrale, non è stato possibile rispettare una frequenza regolare per le uscite di campo né procedere a rilevamenti standardizzati; il numero di specie realmente presente è certamente superiore a quello qui presentato, soprattutto per quanto riguarda i Passeriformi e le specie acquatiche più elusive.
Risultati
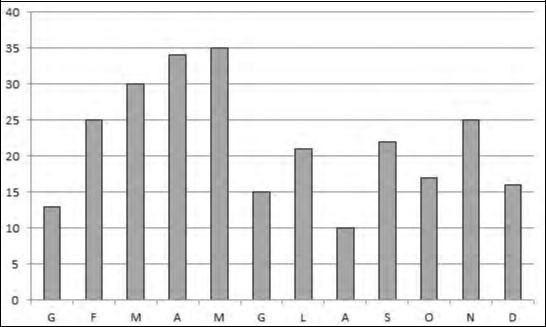
Nel complesso sono state rilevate 72 specie, riportate nella Tabella 1. I non Passe-riformi sono 51 (71% del totale) ed i Passeriformi 21 (29%); i Passeriformi sono l’ordine più ricco di specie, seguito da Caradrifomi e Anseriformi. Quindici specie sono incluse nell’Allegato I della Direttiva Uccelli 147/09/CE, mentre 18 sono considerate “minacciate” nella Lista Rossa degli uccelli nidificanti in Italia (Pero-nace et al., 2012). La ricchezza specifica varia nel corso dell’anno come in graf. 1; il picco si osserva nel mese di maggio, mentre il minimo di agosto risente del fatto che in questo mese è stata effettuata una sola visita. I bassi valori di gennaio sono invece dovuti alla presenza di ghiaccio in alcune delle uscite effettuate in quel mese.
Di seguito si riassumono i risultati per le specie più rappresentative o di presenza più regolare.
Anseriformi
Tredici le specie osservate appartenenti a quest’ordine; a parte il germano reale (Anas platyrhynchos), osservato tutto l’anno con un massimo di 250 indd. nel mese di novembre e nidificante con alcune coppie, vi sono numerose altre specie di maggior interesse.
Il cigno reale (Cygnus olor) è stato osservato con un massimo di 10 indd.; una coppia vi ha nidificato in quasi tutti gli anni. Modeste e concentrate in febbraio-aprile le presenze di oca selvatica (Anser anser), mentre la volpoca (Tadorna tadorna) è presente tutto l’anno, con picchi di 120 indd. nel maggio 2013; unacoppia con pulcini è stata osservata nello stesso anno. La marzaiola (Anas quer-quedula) si rileva generalmente tra marzo e maggio (picco di 36 indd. nel marzo2015), con una sola osservazione alla fine di agosto. L’alzavola (Anas crecca) è regolarmente presente in gennaio-aprile e settembre-novembre; il valore massimo di 400 indd. è stato registrato nel febbraio 2014. Il fischione (Anas penelope) si concentra invece tra novembre ed aprile, con una presenza massima di 140 indd. (febbraio 2015). Osservata tutto l’anno, tranne in agosto, la canapiglia (Anas strepera): il valore maggiore si deve al febbraio 2015 (120 indd.), mentre la nidificazione è stata accertata in due anni. Il mestolone (Anas clypeata) era presente tra novembre e maggio; nel mese di maggio 2012 erano presenti due coppie, ma non è stato possibile accertarne la nidificazione. Per questa specie il picco è stato di 62 ind. nel febbraio 2014.
Le osservazioni di fistione turco (Netta rufina) si concentrano tra febbraio e luglio, con picco di 22 indd. nel marzo 2014; in diverse occasioni è stata osservata una coppia, ma la nidificazione è stata accertata solo nel luglio 2015. Il moriglione (Aythya ferina) ha utilizzato lo stagno in marzo-giugno e in dicembre, in quest’ul-timo mese sono stati censiti fino a 60 indd.; prove certe della nidificazione di due coppie sono state raccolte nel 2013. Del tutto occasionali infine le osservazioni di moretta (Aythya fuligula) e moretta tabaccata (Aythya nyroca).
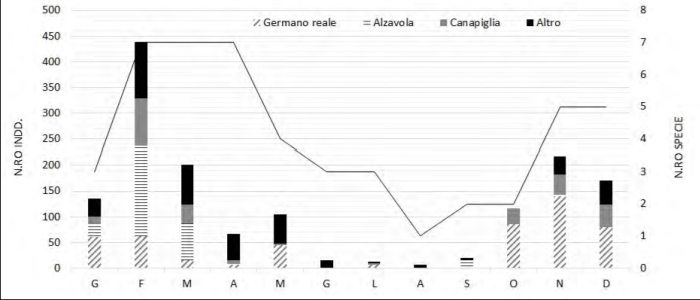
Nel complesso le presenze di Anseriformi raggiungono un picco nel mese di febbraio (Graf. 2), mentre la ricchezza specifica si mantiene ai livelli maggiori tra febbraio e aprile, durante la migrazione pre-nuziale. Il valore minimo di agosto è probabilmente dovuto anche alla carenza di osservazioni effettuate in quel mese.
Podicipediformi
Il tuffetto (Tachybaptus ruficollis) è risultato presente in buona parte dell’anno, con picchi di 22 indd. nel mese di novembre. Ha nidificato ogni anno con 3-5 coppie; la bassa profondità dello stagno, la presenza di macrofite sommerse e invertebrati acquatici sono caratteristiche particolarmente favorevoli alla presenza di questa specie. Lo svasso piccolo (Podiceps nigricollis) è stato invece osservato solo tra ottobre e gennaio, con un massimo di 26 indd.
Pelecaniformi
Al mese di maggio si riferiscono le due osservazioni di specie poco comuni quali la spatola (Platalea leucorodia) ed il mignattaio (Plegadis falcinellus); in giugno e luglio è stato osservato l’ancor più raro ibis sacro (Threskiornis aethiopicus). Numerose le specie appartenenti agli Ardeidi; comuni airone bianco maggiore (Ardea alba), garzetta (Egretta garzetta), airone cenerino (Ardea cinerea) e nitti-cora (Nycticorax nycticorax). Due coppie di airone rosso (Ardea purpurea) si sono probabilmente riprodotte nel 2010 e nel 2011 nel canneto posto al margine dello stagno, ma da allora l’evento non si è più ripetuto.
Suliformi
Il marangone minore (Microcarbo pygmeus) è risultato presente in buona parte dell’anno, ma con numeri molto modesti. Gli individui sono stati osservati in alimentazione, o in sosta sulla vegetazione arbustiva presente sull’isolotto centrale.
Accipitriformi
Tra le specie appartenenti a quest’ordine la più comune è risultata il falco di palude (Circus aeruginosus), osservato quasi ogni mese e la cui nidificazione è stata accertata in un’occasione nel canneto perimetrale. Segue la poiana (Buteo buteo), presente tra settembre ed aprile, mentre le osservazioni di sparviere(Accipiter nisus) sono state più concentrate nel tempo.
Gruiformi
Il porciglione (Rallus aquaticus) è stato rilevato solo in febbraio, aprile ed ottobre; la folaga (Fulica atra) è invece una delle specie di più regolare osservazione, con picchi di 80 indd. nel febbraio 2015. Alcune coppie di questa specie nidificano ogni anno nello stagno.
Caradriformi
Sono 14 le specie presenti; la più comune ed abbondante è il gabbiano reale (Larus michahellis), per via della grande colonia che si trovava nella Cassa di colmata fino al 2015. Nel 2016 la colonia si è molto ridotta, per motivi non chiari. Le altre specie sono state censite con numeri esigui, a parte il cavaliere d’Italia (Himantopus himantopus) osservato con 30 indd.
Coraciformi
Il martin pescatore (Alcedo atthis) è piuttosto comune tra marzo e novembre, mentre il gruccione (Merops apiaster), che si riproduce a poche centinaia di metri, è stato regolarmente osservato tra maggio ed agosto.
Falconiformi
Il gheppio (Falco tinnunculus) è piuttosto comune, mentre in tre occasioni è stato osservato il falco pellegrino (Falco peregrinus), in un caso mentre inseguiva uno stormo di canapiglie.
Passeriformi
Sono venti le specie appartenenti a quest’Ordine e rilevate nel corso dell’indagine; tra queste la più comune è stata l’usignolo di fiume (Cettia cetti), mentre il luì piccolo (Phylloscopus collybita) era presente in febbraio-aprile e in novembre. Cannaiola (Acrocephalus scirpaceus) e cannareccione (Acrocephalus arundinaceus) sono risultate comuni tra aprile e luglio. Viene qui inclusa, benché di poche decine di metri esterna al perimetro dell’area di indagine, anche l’osservazione di una salciaiola (Locustella luscinioides) in canto nel giugno 2013.
Discussione e conclusioni
Pur con le limitazioni già ricordate nei Metodi, le osservazioni effettuate nell’arco di un quadriennio permettono di evidenziare l’importanza dello stagno artificiale della Cassa di colmata D/E per l’avifauna in genere, e per gli Anatidi in particolare. Il valore complessivo di 72 specie presenti è confrontabile con quello rilevato in altri ambienti umidi artificiali del Veneto, come ad esempio le cave senili (Scarton, 2016; Scarton, 2017) o uno stagno incluso nella Zona Industriale di Porto Marghera (Scarton, 1989). Nei ripristini di Valle Vecchia di Caorle, la ricchezza è risultata maggiore (circa 100 specie: Sgorlon, 2016), ma occorre considerare le maggiori dimensioni di queste aree; la correlazione positiva tra dimensioni di una zona umida e numero di specie presenti è ben nota (Di Santo et al., 2015). Il picco di ricchezza specifica osservato in prima-vera riflette quanto noto per le cave senili prima citate, mentre a Valle Vecchia il massimo si osserva in autunno: in entrambi i casi durante i flussi migratori che interessano il nord Adriatico.
L’ordine più abbondate nello stagno della Cassa di colmata D/E è risultato quello degli Anseriformi; picchi di 400 alzavole o 250 germani reali, oltre alla regolare presenza di diverse specie nel periodo febbraio-aprile, sottolineano l’importanza che zone umide artificiali come quella studiata possono avere come sito di sosta durante le migrazioni. Interessante la regolare presenza per quasi tutto l’anno della canapiglia, come osservato anche a Valle Vecchia; anche in Emilia-Romagna la canapiglia ha utilizzato rapidamente le nuove aree umide (Marchesi & Tinarelli, 2007). Meno abbondanti le specie nidificanti, che annoverano però il fistione turco; questa rara specie attualmente si riproduce in poche località del Veneto, con non più di una decina di coppie (Mezzavilla et al., 2016). Il fistione turco viene certamente favorito dalla presenza di nuove zone umide, come dimostrano nel Veneto le sue nidificazioni in Cassa di colmata A e in Valle Vecchia.
L’avvistamento di due ibis sacri nel giugno 2010 risulta uno dei primi effettuati dall’autore nella laguna aperta, nel corso di quasi trent’anni anni di indagini di campo. Questa specie alloctona, benché nota per il Veneto almeno dal 1998 (Bon et al., 2014), in laguna di Venezia diviene sempre più frequente a partire proprio dal 2010.
I rapaci diurni hanno utilizzato lo stagno artificiale lungo l’intero arco annuale; la riproduzione di una coppia di falco di palude dimostra l’importanza che anche corpi idrici di modeste dimensioni, purché dotate di canneti, possono avere per questa rara specie; in tutto il Veneto si stima siano presenti non più di ottanta coppie (Mezzavilla et al., 2016). Le pur rare osservazioni di falco pellegrino confermano la presenza di questa specie nella laguna aperta, situazione che si rileva con regolarità da poco più di un decennio.
I Passeriformi annoverano solo specie comuni per questa tipologia di ambienti umidi, con l’importante eccezione della salciaiola, specie rara nell’intera provincia di Venezia e che negli ultimi si ritiene abbia nidificato solo nei ripristini di Valle Vecchia (Bon et al., 2014). Un risultato fortemente negativo, poiché sembra confermare il drastico calo di entrambe le specie, è invece la totale mancanza di osservazioni di pendolino (Remiz pendulinus) e basettino (Panurus biarmicus); quest’ultima specie era di comune osservazione nei primi anni Ottanta del secolo scorso (oss. pers.) nei canneti della Cassa D/E, che nel 2009-2012 costituivano l’unico sito noto di riproduzione in tutta la provincia di Venezia (Bon et al., 2014). La creazione di una zona umida artificiale ha favorito la presenza regolare di numerosi specie di Anatidi e di un’avifauna nel complesso ricca di specie di interesse conservazionistico, come già evidenziato nei più vasti comprensori di Valle Vecchia e della Cassa di colmata A. Considerato che sono disponibili vaste estensioni, circa 1100 ha, l’intervento potrebbe essere replicato in altre aree della stessa Cassa D/E e della limitrofa Cassa B; trattandosi di aree interne sia ad un SIC che ad una ZPS, le opere troverebbero piena giustificazione in un’ottica di aumento effettivo e duraturo della biodiversità. La necessità di un regolare monitoraggio di medio-lungo periodo, anche in funzione di una gestione adattativa (“adaptive management”) degli interventi, sembrerebbe scontata ma le esperienze pregresse dimostrano che spesso così non è stato.
Fino ad alcuni anni orsono lo stagno artificiale veniva utilizzato per visite guidate, certamente utili per diffondere la conoscenza degli ambienti e della fauna delle Casse di colmata tra i cittadini di Venezia e dei Comuni della gronda lagunare, che perlopiù ne ignorano la presenza. In seguito, l’assenza di semplici interventi manutentori e il sovrasviluppo di Baccharis halimifolia hanno causato la totale obliterazione del sentiero che circonda lo stagno e l’impossibilità di accedere agli osservatori. Questa specie invasiva, recentemente inclusa nell’elenco delle specie invasive vegetali ed animali di rilevanza unionale (Regolamento di Esecuzione UE 2016/1141), fino alla fine degli anni Novanta del secolo scorso era presente nelle Casse di colmata con nuclei sparsi di piccole dimensioni; pochi anni dopo formava compatte estensioni, sviluppatesi anche a scapito di habitat di interesse comunitario come gli junceti. Nel 2016 è stato verificato come nella Cassa D/E e fossero almeno 60 ettari interamente coperti da questa specie invasiva (Baldin Scarton, oss. pers.).
In conclusione, si auspica che nei prossimi piani di interventi finalizzati alla gestione dell’ecosistema lagunare, ad esempio tra quelli previsti dal nuovo Piano per il Recupero morfologico e ambientale della laguna di Venezia (Ministero delle Infrastrutture e dei Trasporti, 2016) o quelli dell’atteso Piano di Gestione della ZPS Laguna di Venezia, si trovi spazio anche per concrete attività di ripristino ambientale e, laddove possibile, di creazione di nuove aree umide d’acqua dolce nelle Casse di colmata.
| G | F | M | A | M | G | L | A | S | O | N | D | ||
| Oca selvatica | Anser anser | X | X | X | |||||||||
| Cigno reale | Cygnus olor | X | X | X | X | X | X | X | X | X | X | ||
| Volpoca | Tadorna tadorna | X | X | X | X | X | X | X | X | ||||
| Canapiglia | Anas strepera | X | X | X | X | X | X | X | X | X | X | X | |
| Fischione | Anas penelope | X | X | X | X | ||||||||
| Germanoreale | Anas platyrhynchos | X | X | X | X | X | X | X | X | X | |||
| Mestolone | Anas clypeata | X | X | X | X | X | |||||||
| Marzaiola | Anas querquedula | X | X | X | X | ||||||||
| Alzavola | Anas crecca | X | X | X | X | X | X | ||||||
| Fistione turco | Netta rufina | X | X | X | X | X | |||||||
| Moriglione | Aythya ferina | X | X | X | X | X | |||||||
| Moretta tabaccata | Aythya nyroca | X | |||||||||||
| Moretta | Aythya fuligula | X | X | ||||||||||
| Tuffetto | Tachybaptus ruficollis | X | X | X | X | X | X | X | X | X | |||
| Svasso piccolo | Podiceps nigricollis | X | X | X | |||||||||
| Ibis sacro | Threskiornis aethiopicus | X | X | ||||||||||
| Mignattaio | Plegadis falcinellus | X | |||||||||||
| Spatola | Platalea leucorodia | X | |||||||||||
| Airone cenerino | Ardea cinerea | X | X | X | X | X | X | X | |||||
| Airone rosso | Ardea purpurea | X | X | ||||||||||
| Airone bianco maggiore | Ardea alba | X | X | X | |||||||||
| Garzetta | Egretta garzetta | X | X | X | X | X | X | X | |||||
| Marangone minore | Macrocarbo pygmeus | X | X | X | X | X | X | X | X | X | |||
| Sparviere | Accipiter nisus | X | X | X | |||||||||
| Falco di palude | Circus aeruginosus | X | X | X | X | X | X | X | X | X | |||
| Albanella reale | Circus cyaneus | X | |||||||||||
| Poiana | Buteo buteo | X | X | X | X | X | X | ||||||
| Folaga | Fulica atra | X | X | X | X | X | X | X | X | X | X | ||
| Beccaccia di mare | Haematopus ostralegus | X | X | X | X | ||||||||
| Cavaliere d’Italia | Himantopus himantopus | X | X | X | X | X | |||||||
| Avocetta | Recurvirostra avosetta | X | |||||||||||
| Porciglione | Rallus aquaticus | X | X | X | X | ||||||||
| Pavoncella | Vanellus vanellus | X | |||||||||||
| Pivieressa | Pluvialis squatarola | X | X | ||||||||||
| Chiurlo maggiore | Numenius arquata | X | |||||||||||
| Totano moro | Tringa erythropus | X | |||||||||||
| Pettegola | Tringa totanus | X | X | ||||||||||
| Pantana | Tringa nebularia | X | |||||||||||
| Piro piro culbianco | Tringa ochropus | X | |||||||||||
| Piro piro piccolo | Actitis hypoleucos | X | |||||||||||
| Gabbiano comune | Chroicocephalus ridibundus | X | X | X | X | X | X | X | |||||
| Gabbiano reale | Larus michahellis | X | X | X | X | X | X | X | X | X | X | X | X |
| Sterna zampenere | Gelochelidon nilotica | X | |||||||||||
| Fraticello | Sternula albifrons | X | |||||||||||
| Cuculo | Cuculus canorus | X | X | X | X | ||||||||
| Martin pescatore | Alcedo atthis | X | X | X | X | X | X | X | X | ||||
| Gruccione | Merops apiaster | X | X | X | X | ||||||||
| Upupa | Upupa epops | X | X | ||||||||||
| Picchio rosso maggiore | Dendrocopos major | X | X | ||||||||||
| Picchio verde | Picus viridis | S | |||||||||||
| Gheppio | Falco tinnunculus | X | X | X | X | X | X | ||||||
| Falco pellegrino | Falco peregrinus | X | X | X | |||||||||
| Rigogolo | Oriolus oriolus | X | |||||||||||
| Gazza | Pica pica | X | |||||||||||
| Cinciallegra | Parus major | X | |||||||||||
| Pendolino | Remiz pendulinus | X | |||||||||||
| Topino | Riparia riparia | X | |||||||||||
| Rondine | Hirundo rustica | X | X | ||||||||||
| Balestruccio | Delichon urbicum | X | |||||||||||
| Usignolo di fiume | Cettia cetti | X | X | X | X | X | X | ||||||
| Luì piccolo | Phylloscopus collybita | X | X | X | X | ||||||||
| Cannareccione | Acrocephalus arundinaceus | X | X | X | |||||||||
| Cannaiola comune | Acrocephalus scirpaceus | X | X | X | |||||||||
| Cannaiola verdognola | Acrocephalus palustris | X | |||||||||||
| Salciaiola | Locustella luscinioides | X | |||||||||||
| Beccamoschino | Cisticola juncidis | X | X | X | X | ||||||||
| Scricciolo | Troglodytes troglodytes | X | |||||||||||
| Pettirosso | Erithacus rubecula | X | X | X | X | ||||||||
| Saltimpalo | Saxicola torquatus | X | X | ||||||||||
| Culbianco | Oenanthe oenanthe | X | |||||||||||
| Cutrettola | Motacilla flava | X | X | ||||||||||
| Migliarino di palude | Emberiza schoeniclus | X | X |


Ringraziamenti
Un particolare ringraziamento ai colleghi che hanno condiviso le numerose uscite di campo: M. Baldin, P. Bertoldo, E. Checchin, D. Longo. M. Bon e F. Mezzavilla hanno apportato utili correzioni al testo.
Bibliografia
Bon M., Scarton F., Stival E., Sattin L., Sgorlon G. (2014) – Nuovo Atlante degli uccelli nidificanti e svernanti in provincia di Venezia. Associazione Faunisti Veneti, Museo di Storia Naturale di Venezia, 255 pp.
Brand A. B., Snodgrass J. W. (2010) – Value of artificial habitats for amphibian repro-duction in altered landscapes: Contributed paper. ConservationBiology, 24: 295-301.
Comune di Mira (2007) -Rapporto sullo stato dell’ambiente a Mira. 79 pp.
Dal Cin L., Bendoricchio G., Coffaro G. (2002) – Linee Guida per la ricostruzione di aree umide per il trattamento di acque superficiali. ANPA, Roma.
D’Antoni S., Battisti C., Cenni M., Rossi G.L. (a cura di) (2011) – Contributi per la tutela della biodiversità delle zone umide. Rapporti ISPRA 153/11.
Di Santo, M. P., Carpaneto, G. M., Battisti C. (2015) – Water-related bird assemblages in an urban pond “archipelago”: Winter patterns of bird species occurrence, abundance and richness. Lakes and Reservoirs: Research and Management, 20: 33-41.
Hansson L. A., Brönmark C., Anders Nilsson P.,Åbjörnsson K. (2005) – Conflicting demands on wetland ecosystem services: nutrient retention, biodiversity or both?
Freshwater Biology,50: 705-714.
Hsu, C. Bin, Hsieh, H. L., Yang, L., Wu, S. H., Chang, J. S., Hsiao, S. C., Lin, H. J. (2011) – Biodiversity of constructed wetlands for wastewater treatment. Ecological Engineering,37: 1533-1545.
ISPRA-Istituto Superiore per la Protezione e Ricerca Ambientale (2012) – Guida tecnica per la progettazione e gestione dei sistemi di fitodepurazione per il trattamento delle acque reflue urbane. Manuali e linee guida 12, 188 pp.
Kravos K., Candotto S., Perco F.(2014) – Compendio Avifaunistico (1990-2013). Riserva Naturale Foce Isonzo, 152 p.
Marchesi F., Tinarelli R. (2007) – Risultati delle misure agro ambientali per la biodi-versità in Emilia-Romagna. Regione Emilia-Romagna, Bologna, 153 pp.
Mezzavilla F., Scarton F., Bon M. (2016) – Gli uccelli del Veneto. Biologia, distribu-zione, abbondanza. Zanetti Ed., 424 pp.
Ministero delle Infrastrutture e dei Trasporti(2016) – Studio C.2.IV – Aggiornamento del Piano Morfologico in base alle richieste dell’Ufficio di Piano. Consorzio Venezia Nuova, 388 pp. Internet: http://provveditoratovenezia.mit.gov.it. Ultimo accesso: 14 febbraio 2017.
Murray C., Hamilton A. (2010) – Perspectives on wastewater treatment wetlands and waterbird conservation. Journal of Applied Ecology, 47: 976-985.
Peronace V., Cecere J., Gustin M., Rondinini C. (2012) – Lista Rossa 2011 degli Uccelli Nidificanti in Italia. Avocetta, 36: 11-58.
Scarton F. (1989) – L’avifauna in un ambiente industriale: un esempio nella Laguna di Venezia. Riv. ital. Orn., 59: 316-318.
Scarton F. (2016) – L’avifauna di ambienti umidi artificiali con elevato disturbo antropico: le cave di Casale sul Sile (TV). In: Bonato L., Trabucco R., Bon M. (eds.) (2016) – Atti 7° Convegno Faunisti Veneti. Boll. Mus. St. Nat. Venezia, suppl. al vol. 66: 155-160. Scarton F. (2017) – Prime indagini sull’avifauna delle Cave Carlesso (Morgano, TV).
Lavori Società Veneziana Scienze Naturali,42: 35-42.
Scarton F., Bon M., Trebbi O. (in stampa). Importanza di un impianto di fitodepura-zione per l’avifauna acquatica nidificante e svernante. Il caso della Cassa di colmata A (Mira, VE). Reaserch in Ornithology.
Scarton F., Semenzato M., Tiloca G., Valle R. (2000) – L’avifauna nidificante nelle casse di colmata B e D/E (non-Passeriformes): situazione al 1998 e variazioni intercorse negli ultimi venti anni. Boll. Museo Civ. St. Nat. Venezia, 50: 249-261.
Semenzato M. (2002) – Le casse di colmata: un “laboratorio” lagunare dove rinasce la natura. Rive, 2: 50-57.
Sgorlon G. (2016) – La comunità ornitica in un sito oggetto di ripristino ambientale: la ZPS Valle Vecchia di Caorle (provincia di Venezia). In: Bonato L., Trabucco R., Bon M. (eds.) (2016) – Atti 7° Convegno Faunisti Veneti. Boll. Mus. St. Nat. Venezia, suppl. al vol. 66: 106-111.
Sirami, C., Jacobs, D. S., Cumming G. S. (2013) – Artificial wetlands and surrounding habitats provide important foraging habitat for bats in agricultural landscapes in the Western Cape, South Africa. Biological Conservation, 164: 30-38.
Veneto Agricoltura (2014) – La fitodepurazione per il trattamento di acque di origine agricola e di reflui zootecnici. Azienda Regionale per i Settori Agricolo, Forestale ed Agroalimentare, 44 pp.

