Riassunto
Tra il gennaio 2014 e il dicembre 2015 sono state effettuate 26 visite alle cave Carlesso (Morgano, TV) per il rilievo dell’avifauna presente. Sono state contattate 65 specie (76 stimate con l’indica-tore Chao 2), di cui 34 Passeriformi: nove specie risultano incluse nell’Allegato I Direttiva 147/09 Uccelli. La media di specie per uscita è stata di 17,2 (d.s.=4,4; min=9, max=23). I periodi con il maggior numero medio di specie (20) sono stati febbraio-aprile e novembre-dicembre. Sono state rilevate 23 specie nidificanti, tra cui nitticora Nycticorax nycticorax, tarabusino Ixobrychus minutus, martin pescatore Alcedo atthis, sparviere Accipiter nisus; è presente anche un dormitoriodi airone guardabuoi Bubulcus ibis. La scarsa presenza di canneto e il disturbo antropico che si osserva in buona parte dell’anno limitano in parte le presenze di avifauna nell’area di indagine, che pure costituisce un sito di interesse in un contesto fortemente antropizzato.
Abstract
First surveys of the birds of “cave Carlesso” (Morgano, TV, Italy)
Between January 2014 and December 2015 the birds occurring in the abandoned clay pit named “cave Carlesso” (Morgano, Treviso, NE Italy) were surveyed. A total of 65 species were recorded (76, using the Chao2 estimator), with nine listed in the Annex I of the 147/09 EU Birds Directory. Mean number of species per visit was 17.2 (s.d. =4.4; range 9-23). The periods with the highest mean number of species per visit (20) were February-April and November-December. Twenty-three species nested: among these, there were Nycticorax nycticorax, Ixobrychus minutus, Alcedo at-this, Accipiter nisus. The poor occurrence of reeds and the high anthropic disturbance, mostly due to anglers, limit somewhat the bird occurrence, but the site nevertheless maintains its importance for the wildlife in a highly urbanized context.
Premessa
La pianura veneta presenta numerose cave di materiali litoidi quali ghiaia, sabbia e argilla, spesso non più utilizzate da decenni; dall’elenco cave dismesse della Regione Veneto si evince che circa 700 di queste hanno cessato la coltivazione dopo il 1976 (Regione Veneto, 2016). Qualora non siano stati effettuati interventi di “ricomposizione agraria”, in parte di questi bacini artificiali i naturali processi colonizzativi hanno portato alla costituzione di habitat naturali, o seminaturali, che possono risultare di notevole valore per la fauna selvatica e per l’avifauna in particolare (si vedano ad esempio ARPAV, 2004 e Zanetti, 2014). Tra gli esempi più interessanti si citano le cave di Cinto Caomaggiore (VE), Salzano (VE), Gaggio (VE), Casale (VI) dove l’avifauna si è insediata da diversi anni e appare in progressivo aumento in termini di ricchezza e abbondanza (Scarton et al., 2013; Sartori & D’Alterio, 2016; Stival et al., 2011).
Le indagini ornitologiche relative alle cave senili del Veneto, dopo un periodo di iniziale grande fervore (Molinari et al., 1985; Amato & Semenzato., 1988; Stival., 1992), si sono notevolmente diradate in seguito (Baldin et al., 2005; Stival et al., 2011). Molto recentemente vi sono stati nuovi contributi che hanno presentato dati originali ed aggiornati (Micheletti et al., 2016; Sartori & D’Alterio, 2016; Scarton, 2016); per la maggior parte delle cave senili del Veneto le informazioni attualmente disponibili sull’avifauna che le utilizza ri-mangono però episodiche e di solito poco circostanziate, oppure si limitano a riprendere acriticamente quanto noto per il passato.
Nel Comune di Morgano (TV) le cosiddette cave Carlesso, o cave di Via Bo-sco, sono state utilizzate fino agli anni Settanta del secolo scorso per il prelievo di argilla (Franco, 2004). Successivamente al loro abbandono parte dei bacini è stata colmata per utilizzi agrari, mentre altri si sono spontaneamente naturalizzati, con il progressivo affermarsi di vegetazione acquatica, arbustiva ed arborea. Sulle cave Carlesso sono state condotte indagini specifiche relative alla vegetazione da Franco (2004), da cui sono state tratte anche alcune informazio-ni generali di seguito presentate, e all’erpetofauna da Romanazzi & Menegon (2007). Per la fauna e l’avifauna in particolare alcuni dati puntuali vengono presentati da Franco (2004), Mezzavilla & Bettiol (2007) e Regione del Veneto (2010).
Stante il potenziale interesse ornitologico delle cave Carlesso, comprese nel perimetro del Parco Naturale Regionale del Fiume Sile, nella ZPS IT3240011 “Sile Sorgenti, Paludi di Morgano e S.Cristina” e nel SIC IT3240028 “Fiume Sile dalle sorgenti a Treviso Ovest” si presenta in questo contributo il primo quadro conoscitivo dettagliato circa l’avifauna che le utilizza nell’arco dell’intero ciclo annuale.
Area di studio e metodi
Le cave Carlesso (45° 38’ 06’’ N; 12° 06’50” E) sono composte principalmente da una dozzina di bacini contigui e delimitati da argini in terra, aventi estensione di circa 7,3 ha; da un bacino di 0,7 ha separato dagli altri e posto a NE di essi; da circa 4,3 ha di terreni interclusi, comprensivi di un pioppeto artificiale e di aree agricole destinate a foraggere e mais. L’estensione totale qui considerata è pertanto di 12,3 ettari. L’area è delimitata a nord da terreni agricoli adiacenti la strada che unisce gli abitati di Ongarie e di Settimo, a sud dal tracciato dell’ex linea ferroviaria Treviso-Ostiglia attualmente occupato da una pista ciclabile, ad est da terreni prossimi alla strada che da Settimo si dirige verso sud, a occidente da una strada sterrata a decorso nord-sud. Le presenze antropiche nelle cave, ad accesso libero e incontrollato, si devono principalmente ai pescasportivi, mentre l’adiacente pista ciclabile è particolarmente frequentata nei fine settimana.
Il nucleo principale delle cave è costituito da bacini originati da fosse di cava abbandonate al termine dell’attività estrattiva ed aventi profondità compresa tra 0.8 e 3 metri. Le acque sono di origine risorgiva e i bacini sono in gran parte comunicanti tra loro. Lungo gli argini che li separano si è sviluppata nel tempo una rigogliosa vegetazione arborea ed arbustiva, con dominanza di Salix alba, S. purpurea, Alnus glutinosa, Acer campestre e Robinia pseudacacia; sono presentianche pochi esemplari di buone dimensioni di farnia Quercus robur. Le idrofite sono rappresentate prevalentemente da Nymphaea alba; mentre tra le igrofite pochi lembi di Phragmites australis e Typha latifolia sono presenti lungo i mar-gini di alcuni bacini.
Tre uscite per il rilievo dell’avifauna sono state effettuate tra gennaio e ottobre 2014, mentre da novembre 2014 a dicembre 2015 la cadenza è stata ogni quin-dici-venti giorni, per un totale di 26 visite. Durante ciascuna di esse si è seguito a piedi lo stesso percorso all’interno delle cave, effettuandolo in circa due ore; le osservazioni hanno avuto sempre luogo tra le 7 e le 10, evitando giornate con forti precipitazioni o fitta nebbia. Trattandosi delle prime indagini ornitologi-che compiute nell’area si è preferito massimizzare il numero di specie rilevate, quindi non si sono eseguiti transetti o punti di ascolto.
Sono state rilevate tutte le specie osservate o udite all’interno dell’area di indagine, escludendo quelle in volo alto e direzionale; solo per alcune specie si sono conteggiati gli individui. La nidificazione è stata classificata secondo gli usuali criteri utilizzati nei progetti Atlante (si veda ad esempio Bon et al., 2014), men-tre l’ordine sistematico e la terminologia sono quelli di Brichetti & Fracasso (2015).
Per stimare il numero “vero” di specie presenti nell’area di indagine, assumendo che come spesso accade in campo solo una parte di esse sia stata rilevata (Magurran, 2004; Gotelli & Colwell, 2011; Storch, 2011), è stato calcolato anche l’estimatore non parametrico Chao2, basato sulla presenza/assenza delle specie in ciascuna visita ed ottenuto mediante il software Estimates (Colwell, 2013). Con lo stesso programma è stata calcolata la curva di rarefazione delle specie in funzione del numero di uscite; questa curva esprime il numero atteso di specie in un piccolo gruppo di n visite, preso a caso dal numero N totale delle visite effettuate.
Risultati
Sono state complessivamente rilevate 65 specie, di cui 31 (47.7%) non Pas-seriformi; il rapporto Passeriformi/non Passeriformi si è mantenuto piuttosto stabile nell’arco dell’anno (Fig. 1 e Tab. 1).
Il numero medio di specie contattate in un’uscita è stato di 17,2 (d.s.= 4,4), con valore minimo di nove (7 settembre 2014) e massimo di 23 (15 aprile, 1 giugno e 24 dicembre 2015). Due i periodi con il maggior numero medio di specie per ciascuna visita, vale a dire febbraio-aprile (21) e novembre-dicembre (20). L’in-dice di Chao2 è risultato pari a 76 specie (intervallo di confidenza non simmetri-co: 68-100), ossia circa il 17% in più rispetto al numero specie rilevato in campo.
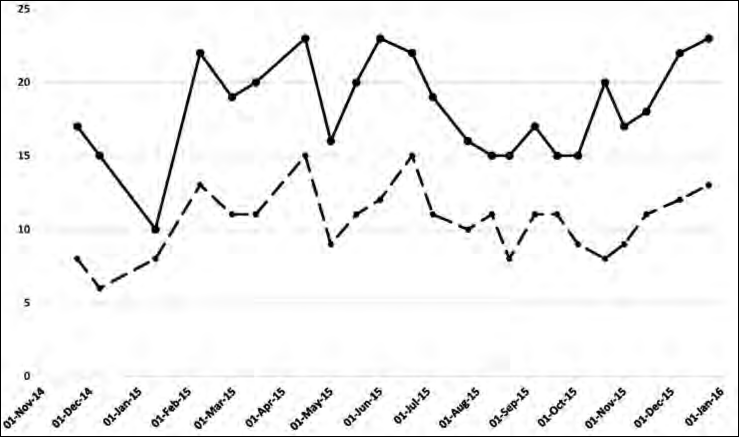
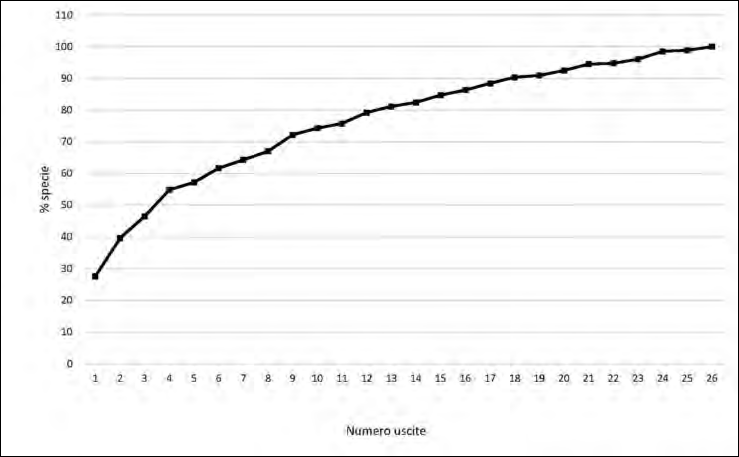
La curva di rarefazione (Fig. 2) evidenzia come risultino necessarie 18 uscite per arrivare a rilevare il 90%, oppure 22 uscite per il 95%, delle specie osservate nell’arco di tutta l’indagine. Diverse tra le specie che utilizzano le cave Carlesso sono di interesse conservazionistico: nove rientrano nell’Allegato I della Diret-tiva 147/09 Uccelli (Tab. 1) mentre sei (falco di palude Circus aeruginous, mar-zaiola Anas querquedula, nitticora Nycticorax nycticorax, passera d’Italia Passer italiae, pendolino Remiz pendulinus e tarabusino Ixobrychus minutus) hannolo status di “Vulnerabile” nella Lista Rossa degli Uccelli Nidificanti in Italia (Peronace et al., 2012). Da sottolineare che il marangone minore Microcarbo pigmeus, unica tra le specie rilevate, ha qualifica di SPEC 1 nella lista elaboratada BirdLife International (2004).
Le specie nidificanti, probabili o certe, sono risultate 23, tra cui alcune di inte-resse conservazionistico come il tarabusino (1-2 coppie), la nitticora (una cop-pia) ed il martin pescatore Alcedo atthis (2-3 coppie).
Tra gli anatidi (Tab. 1) l’unica specie comune è il germano reale Anas platyrhyn-chos, con un massimo di 45 individui nel novembre 2015; gli esemplari si radu-navano spesso nel bacino posto più a N-E, il meno disturbato. Da tre a cinque coppie di questa specie hanno nidificato nell’area. Il fischione Anas penelope è risultato di presenza del tutto occasionale, mentre la marzaiola è stata osservata con 2-6 individui tra marzo e aprile.
La presenza diurna del marangone minore è regolare ma contenuta, con un massimo di 15 indd. l’8/2/2015; al contrario il cormorano Phalacrocorax carbo è risultato molto raro, osservato solo nel dicembre 2015. Il tarabusino è stato contattato regolarmente in giugno-luglio e si stima si riproducano nelle cave una-due coppie. Tra gli ardeidi, sono risultati presenti in buona parte dell’anno sia la garzetta Egretta garzetta che l’airone cenerino Ardea cinerea, mentre le altre specie sono molto meno comuni; l’osservazione ripetuta di adulti e giovani di nitticora lascia ritenere che tale specie si sia riprodotta nell’area di studio, an-che se non si può del tutto escludere che gli individui provenissero dalla vicina garzaia di Santa Cristina. Poco dopo la conclusione dell’indagine, nel gennaio 2016 è stata verificata la presenza di un dormitorio serale composto da circa 300 aironi guardabuoi Bubulcus ibis, insediati su alcuni alberi di grandi dimensioni posti nel settore meridionale delle cave.
Tra gli altri uccelli acquatici, il porciglione Rallus aquaticus è stato contattato solo tra dicembre e febbraio, mentre folaga Fulica atra e gallinella d’acqua Gallinula chloropus sono stanziali, con 4-5 coppie della prima specie e cinque-sei dell’altra.Tra i rapaci diurni, probabile la nidificazione di una coppia di sparviere Acci-piter nisus; lodolaio Falco columbarius, falco pellegrino Falco peregrinus e falcodi palude sono stati osservati ciascuno in una sola occasione, mentre la poiana Buteo buteo è regolarmente presente tra i primi di settembre e metà aprile. Ilcolombaccio Columba palumbus è stato osservato tutto l’anno, con stormi che possono arrivare a circa 280 individui nei mesi di novembre e dicembre, in sosta o in alimentazione nei campi interni alle cave; la tortora selvatica Strepto-pelia turtur ha nidificato nell’area con qualche coppia ed è stata rilevata solo tragiugno ed agosto. Nello stesso periodo erano presenti rigogolo Oriolus oriolus, gruccione Merops apiaster (in una sola occasione) e cuculo Cuculus canorus. Martin pescatore, picchio verde Picus viridis e picchio rosso maggiore Dendro-copos major sono nidificanti e presenti tutto l’anno.
Infine, le specie più comuni di Passeriformi sono risultate quelle tipiche di formazioni arboree, quindi capinera Sylvia atricapilla, ghiandaia Garrulus glandarius, merlo Turdus merula, usignolo Luscinia megarhynchos, codibu-gnolo Aegithalos caudatus, cinciallegra Parus major e cinciarella Cyanistes ca-eruleus. I Passeriformi legati ai canneti sono risultati invece molto rari; solola cannaiola comune Acrocephalus scirpaceus è da considerarsi probabilmente nidificante, mentre usignolo di fiume Cettia cetti e migliarino di palude Em-beriza schoeniclus sono stati contattati esclusivamente da ottobre a marzo.Il pendolino è stato rilevato in una sola occasione (16 marzo 2014), con 16 individui in sosta.
| G | F | M | A | M | G | L | A | S | O | N | D | Nid. | |
| Anas penelope | X | X | X | X | X | X | X | X | X | X | X | X | SÌ |
| Anas platyrhynchos | |||||||||||||
| Anas querquedula | X | X | |||||||||||
| Phasianus colchicus | X | X | X | X | X | X | X | X | X | SÌ | |||
| Ixobrychus minutus | X | X | SÌ | ||||||||||
| Nycticora xnycticorax | X | X | X | X | X | X | X | X | X | SÌ | |||
| Bubulcus ibis | |||||||||||||
| Ardea cinerea | X | X | X | X | X | X | X | ||||||
| Ardea purpurea | X | X | X | ||||||||||
| Ardea alba | |||||||||||||
| Egretta garzetta | X | X | X | X | X | X | X | X | |||||
| Phalacrocorax carbo | X | ||||||||||||
| Microcarbo pygmeus | X | X | X | X | X | X | X | X | |||||
| Accipiter nisus | X | X | X | X | X | X | X | SÌ | |||||
| Circus aeruginosus | X | X | X | X | X | X | X | ||||||
| Buteo buteo | |||||||||||||
| Rallus aquaticus | X | X | |||||||||||
| Gallinula chloropus | X | X | X | X | X | X | X | X | X | X | X | X | SÌ |
| Fulica atra | X | X | X | X | X | X | X | X | X | X | X | X | SÌ |
| Larus michahellis | X | ||||||||||||
| Columba palumbus | X | X | X | X | X | X | X | X | X | X | X | X | SÌ |
| Streptopelia turtur | X | X | X | X | X | SÌ | |||||||
| Streptopelia decaocto | X | SÌ | |||||||||||
| Cuculus canorus | X | ||||||||||||
| Apus apus | |||||||||||||
| Alcedo atthis | X | X | X | X | X | X | X | X | X | X | X | X | SÌ |
| Merops apiaster | X | ||||||||||||
| Picus viridis | X | X | X | X | X | X | X | X | X | X | X | X | SÌ |
| Dendrocopos major | X | X | X | X | X | X | X | X | X | X | X | X | SÌ |
| Falco subbuteo | X | X | |||||||||||
| Falco peregrinus | X | X | X | ||||||||||
| Hirundo rustica | |||||||||||||
| Delichon urbicum | X | ||||||||||||
| Oriolus oriolus | X | X | X | X | SÌ | ||||||||
| Corvus cornix | X | X | X | ||||||||||
| Corvus monedula | X | X | |||||||||||
| Pica pica | X | X | X | X | X | X | X | X | X | X | X | X | SÌ |
| Garrulus glandarius | X | X | X | X | X | X | X | X | X | X | X | SÌ | |
| Remiz pendulinus | X | ||||||||||||
| Parus major | X | X | X | X | X | X | X | X | X | SÌ | |||
| Cyanistes caeruleus | X | X | X | ||||||||||
| Cettia cetti | X | X | X | X | |||||||||
| Aegithalos caudatus | X | X | X | X | X | X | X | X | X | X | SÌ | ||
| Phylloscopus collybita | X | X | X | X | X | X | X | SÌ | |||||
| Acrocephalus scirpaceus | |||||||||||||
| Acrocephalus palustris | X | X | SÌ | ||||||||||
| Sylvia atricapilla | X | X | X | X | SÌ | ||||||||
| Regulus regulus | |||||||||||||
| Troglodytes troglodytes | X | X | X | X | X | X | |||||||
| Sturnus vulgaris | |||||||||||||
| Turdus merula | X | X | X | X | X | X | X | X | X | X | X | X | SÌ |
| Turdus pilaris | X | ||||||||||||
| Erithacus rubecula | X | X | X | X | X | X | |||||||
| Luscinia megarhynchos | X | X | X | X | X | SÌ | |||||||
| Ficedula hypoleuca | X | ||||||||||||
| Passer italiae | X | X | |||||||||||
| Motacilla alba | X | ||||||||||||
| Motacilla cinerea | X | ||||||||||||
| Anthus pratensis | |||||||||||||
| Fringilla coelebs | X | X | X | X | |||||||||
| Coccothraustes coccothraustes | X | X | X | ||||||||||
| Carduelis carduelis | X | ||||||||||||
| Serinus serinus | X | X | |||||||||||
| Carduelis spinus | |||||||||||||
| Emberiza schoeniclus | X | X | X | X |
Tab. 1. Elenco delle specie osservate (26 uscite) con indicazione della nidificazione nelle cave Carlesso.
Discussione e conclusione
Le cave Carlesso si caratterizzano per un’avifauna discretamente ricca, a confer-ma del valore che anche corpi idrici di modesta estensione possono avere in un contesto fortemente antropizzato quale quello della pianura veneta e trevigiana in particolare. Il numero di specie osservato (65) è di poco inferiore a quello rilevato presso le cave di Casale sul Sile (TV) in un’analoga indagine com-piuta recentemente (Scarton, 2016) e superiore alle 52 specie osservate alle cave di Noale (Baldin et al., 2005); i risultati non sono invece comparabili con quelli relativi alle cave di Gaggio (189 specie: Stival et al., 2011) per la durata molto diversa dei due studi. L’andamento temporale della ricchezza specifica, con minimi in settembre e massimi in aprile, è sovrapponibile a quello registra-to per le cave di Casale sul Sile e di Noale (Baldin et al., 2005); per le cave senili appare evidente un intenso utilizzo durante la migrazione primaverile, special-mente ad opera dei Passeriformi e in secondo luogo degli uccelli acquatici.
Il numero di specie osservate è risultato poco inferiore a quello statisticamente atteso, ad indicazione che il piano di campionamento è stato efficiente; anche la frequenza delle uscite è risultata idonea per ambienti come quelli conside-rati. L’utilizzo di questi pur semplici indicatori statistici è di solito totalmente ignorato nelle indagini ornitologiche compiute nel Veneto da appassionati ed esperti (ma si veda Mezzavilla, 2014 per un’applicazione recente); se ne con-siglia l’utilizzo al fine di una più corretta valutazione dei propri risultati e per allinearsi alla più recente letteratura scientifica.
Tralasciando le specie osservate una sola volta (17: 26.5%), tra cui alcune di interesse ma che non possono essere considerate particolarmente rappresentative dell’area, quelle che compongono la comunità ornitica delle cave appartengono ai Passeriformi e a un ristretto numero di specie acquatiche. La totale assenza di uccelli acquatici piuttosto tolleranti rispetto al disturbo antropico come tuffetto Tachybaptus ruficollis e svasso maggiore Podiceps cristatus si spiega anche conl’attuale ridottissima presenza di canneto; questa vegetazione sembra fosse più abbondante all’inizio del Duemila, stando a quanto riportato da Franco (2004). La scarsa presenza di habitat idoneo contribuisce a spiegare anche la rarità dell’u-signolo di fiume, molto comune invece alle cave di Casale sul Sile, e della can-naiola comune. Analoga considerazione vale per il cannareccione Acrocephalus arundinaceus, che nidificava nelle cave Carlesso nel 2003-2006 (Mezzavilla&Bettiol, 2007) mentre non è stato mai contattato durante la presente indagine.
Il pendolino è stato osservato solo in una occasione, pur essendoci habitat potenzialmente idonei; la stessa rarità è stata documentata per le cave di Casale sul Sile, in un’indagine condotta per oltre due anni (Scarton, 2016). La specie veniva data in provincia di Treviso come nidificante comune ed in buono stato di conservazione (anni 2003-2006: Mezzavilla & Bettiol, 2007), ma è probabile che la situazione recente sia molto peggiorata; un’indagine su tutto il territorio provinciale sarebbe quanto mai necessaria per accertarne l’attuale distribuzione. Pochissime le specie di anatidi che frequentano regolarmente le cave Carlesso; in questo caso il disturbo pressoché costante che si osserva da marzo a novem-bre lungo i bacini privi di vegetazione arginale ne è certamente la causa. Il tara-buso Botaurus stellaris non è mai stato osservato nel corso dell’indagine, benché nel territorio provinciale frequenti regolarmente in inverno cave e altri piccoli corpi idrici (oss. pers.); per questa specie la scarsa presenza di canneto, e secon-dariamente il disturbo antropico, concorrono a determinarne la sua assenza.
Le cave Carlesso sono invece regolarmente utilizzate da marangone minore, garzetta, airone cenerino e nitticora, sia per fini trofici che per la sosta; la nidi-ficazione della nitticora e la presenza di un consistente dormitorio notturno di airone guardabuoi sono elementi di sicuro valore.
La regolare osservazione, in alcuni casi anche la nidificazione, di alcune specie di rilievo conservazionistico come marzaiola, tarabusino, marangone minore, garzetta e martin pescatore e più in generale di un’interessante comunità ornitica sono elementi che dovrebbero giustificare, in un’ottica di conservazione e di incremento della diversità, anche minimi interventi di gestione attiva dell’area. Tra questi si possono citare una pur blanda regolamentazione dell’accesso, la rimozione dei rifiuti presenti lungo gli argini e in alcuni corpi idrici, il control-lo della vegetazione infestante. Nonostante le cave Carlesso siano incluse in due Siti Natura 2000 ed in un Parco Regionale, attualmente questi interventi sono totalmente assenti né sembrano essere previsti sul breve-medio periodo. A fronte di corposi piani di gestione che prevedono e catalogano minuziosamente tutte le azioni da intraprendere, nulla appare in seguito trasferirsi nella pratica ordinaria. Anche il monitoraggio faunistico di base, unica attività in grado di fornire i dati aggiornati e le conoscenze necessarie per la gestione degli habitat e delle specie, è lasciato alla sola iniziativa di esperti locali, come avviene per altre cave senili del Veneto. La pressoché totale assenza nelle pubbliche ammi-nistrazioni di una politica di acquisizione di dati scientificamente attendibili, condotta con campagne di indagini standardizzate svolte sul medio-lungo pe-riodo, limita fortemente la possibilità di ampliare le conoscenze su ambienti di rilevante interesse naturalistico quali le cave senili e preclude del tutto la possi-bilità di valutare correttamente i cambiamenti in atto anche nella nostra regione circa distribuzione e abbondanza di numerose specie di uccelli.
Ringraziamenti
Si ringrazia il Prof. G. Caniglia (Università di Padova) per aver fornito copia della tesi di laurea di A. Franco. M. Bon e F. Mezzavilla hanno effettuato utili revisioni del testo.
Bibliografia
Amato S., Semenzato M. (1988) – Sull’avifauna di alcune cave dell’entroterra venezia-no: 3. Lavori Soc. Ven. Sc. Nat., 13: 115-133
ARPAV (2004) – Censimento delle aree naturali “minori” della regione Veneto. Agen-zia per la Prevenzione e Protezione Ambientale del Veneto, Padova.
Baldin M., Antinori F., Castelli S., Ciriello M., Contro M. (2005) – Composizione e struttura della comunità ornitica nelle due oasi di Ca’ Roman e delle cave di No-ale (VE) ed analisi per tipologia ambientale. In: Bon M., Dal Lago A., Fracasso G. (red.), Atti 4° Convegno Faunisti Veneti. Natura Vicentina, 7: 151-158.
BirdLife International (2004) – Birds in the European Union: a status assessment.
BirdLife International, Wageningen,The Netherlands. BirdLife International.
Bon M., Scarton F., Stival E., Sattin L., Sgorlon G. (2014) – Nuovo Atlante degli uccelli nidificanti e svernanti in provincia di Venezia. Associazione Faunisti Veneti, Museo di Storia Naturale di Venezia, 255 pp.
Brichetti P., Fracasso G. (2015) – Check-list degli uccelli italiani aggiornata al 2014. Rivista Italiana di Ornitologia – Research in Ornithology,85: 31-50
Colwell R.K. (2013) – Estimate S. Statistical estimation of species richness and shared species from samples. Version 9. URL: purl.oclc.org/estimates
Franco M. (2004) – La palude delle ex cave Carlesso, Badoere di Morgano (TV). Stu-dio della flora e della vegetazione per una proposta di recupero ambientale. Facoltà di Scienze MM., FF. NN, corso di laurea in Scienze Naturali.
Gotelli N. J., Colwell R.K. (2011) – Estimating species richness. In: Magurran A.E.& McGill B.J. (eds). Frontiers in measuring biodiversity. Oxford University Press, New York: 39-54.
Magurran A. (2004) – Measuring biological diversity. Blackwell Publishing, Malden. Mezzavilla F. (2014) – Il faggio e la fauna. Corpo Forestale dello Stato – Ministero delle
Politiche Agricole Alimentari e Forestali, 121 pp.
Mezzavilla F., Bettiol K. (2007) – Nuovo Atlante degli Uccelli nidificanti in provincia di Treviso (2003-2006). Associazione Faunisti Veneti, pp. 200.
Micheletti A., Zanotti M., Boschetti E., Benà E.(2016) – Nuove osservazioni e ag-giornamento sulla distribuzione delle popolazioni di Ardeidi nidificanti e svernanti nel territorio del Polesine occidentale (provincia di Rovigo). In: Bonato L., Trabuc-co R., Bon M. (eds.), 2016. Atti 7° Convegno Faunisti Veneti. Boll. Mus. St. Nat. Venezia, suppl. al vol.66: 179-183.
Molinari A., Sartori A., Stival E. (1985) – Gli uccelli delle cave di Gaggio (Marcon-Venezia). In: Stival E., Barbieri S., Gomiero M., Mazzon M., Merlo A., Molinari
A., Sartori A., Stival M. (eds.), 1985. Le cave di Gaggio. LIPU – Biblioteca di Marcon – Biblioteca di Quarto d’Altino.
Peronace V., Cecere J., Gustin M., Rondinini C. (2012) – Lista Rossa 2011 degli Uc-celli Nidificanti in Italia. Avocetta, 36: 11-58.
Regione del Veneto (2016) – https://www.regione.veneto.it/web/ambiente-e-territorio/cave1 Regione del Veneto (2010) – Piano di Gestione n.16. Z.P.S. IT3240011 Sile: sorgenti, paludi di Morgano e S. Cristina. 715 pp.
Romanazzi E., Menegon M.(2007) – Il ruolo delle cave dismesse nella conservazione dell’erpetofauna planiziale in provincia di Treviso. De Rerum Natura, Quaderni del Mus. St. Nat. e Archeol. Montebelluna (TV)4: 5-16.
Sartori A., D’Alterio S. (2016) – Una nuova garzaia nel SIC/ZPS ex cave di Villetta di Salzano – Venezia. Lavori Soc. Ven. Sc. Nat. 41: 27-32.
Scarton F. (2016) – L’avifauna di ambienti umidi artificiali con elevato disturbo an-tropico: le cave di Casale sul Sile (TV) In: Bonato L., Trabucco R., Bon M. (eds.), 2016. Atti 7° Convegno Faunisti Veneti. Boll. Mus. St. Nat. Venezia, suppl. al vol. 66: 155-160.
Scarton F., Mezzavilla F., Verza E. (eds.) (2013) – Le Garzaie in Veneto. Risultati dei censi-menti svolti nel 2009-2010. Associazione Faunisti Veneti, Quaderni Faunistici – n. 2. 224 pp.
Stival E., Pegorer M., Basciutti P. (2011) – L’avifauna del SIC e ZPS IT3250016 “Cave di Gaggio”. Atti 6° Convegno Faunisti Veneti, Treviso, 15-16 maggio 2010. A cura di M. Bon, F. Mezzavilla, F. Scarton. Boll. Mus. St. Nat. Venezia,suppl. al vol. 61:171-179. Stival E.(1992) – L’avifauna delle cave di argilla senili del comune di Marcon (Venezia). Boll. Mus. civ. St. Nat. Venezia,41: 235-264.
Storch F. (2011) – Monitoraggio e individuazione di misure di conservazione per la fauna acquatica (invertebrati e anfibi) degli habitat igrofili ed idrofili. Regione auto-noma Friuli Venezia-Giulia, 172 pp.
Zanetti M. (2014) – Fiumi, cave, valli, lagune. Acque della Venezia Orientale. ADLE Edizioni, 214 pp.
